|
(11) | EP 0 009 077 A1 |
| (12) | EUROPÄISCHE PATENTANMELDUNG |
|
|
|
|
|||||||||||||||||||||||
| (54) | Substituierte Phenylpropylhalogenide, ihre Herstellung und Verwendung |
| (57) Neues Verfahren zur Herstellung von Phenylpropylhalogeniden der Formel
durch Umsetzung des entsprechenden allein durch R2 und R' substituierten Phenylpropylhalogenids mit einem Alkohol, Alkylhalogenid der Olefin und Phenylpropylhalogenide, in denen R3 bestimmte Bedeutungen hat. |
[0001] Die vorliegende Erfindung betrifft ein Verfahren zur Herstellung von substituierten Phenylpropylhalogeniden durch Umsetzung von Phenylpropylhalogeniden mit Alkoholen, Alkylhalogeniden oder Olefinen in Gegenwart saurer Katalysatoren und die so erhältlichen Produkte. Sie sind wichtige Ausgangsverbindungen für die Herstellung von entsprechend substituierten Morpholinen oder Piperidinen, die zur Bekämpfung von Pilzen verwendet werden können. Es ist bekannt, Alkylaromaten aus Aromaten und Olefinen mit stark sauren Katalysatoren wie z. B. Schwefelsäure oder Phosphorsäure herzustellen (Friedel-Crafts and Related Reactions, George A. Olah Band II, S. 1 - 288, 1964). Beispielsweise liefert die Alkylierung von Toluol mit Isobutylen in sehr guter Ausbeute p-tert.-Butyltoluol. Setzt man statt Toluol Aromaten mit längeren Alkylketten (z. B. Äthylbenzol, Propylbenzol) ein, so verläuft die Umsetzung deutlich langsamer (R. N. Volkor u. S. v. Zavgorodnij, Dokl. Akad. Nauk S.S.S.R. 133, 843 (1960)). Die Alkylierung von Aromaten mit einer labilen halogenierten Seitenkette unter den üblichen Bedingungen ist nur aus einem Beispiel bekannt (Y. Monteils, Bull. Soc. Chim. France 636, 1951), wo sie eine unbefriedigende Ausbeute ergibt.
[0002] Es wurde nun gefunden, daß man Phenylprcpylhalcgenide der allgemeinen Formel
in der R1 Wasserstoff oder einen aliphatischen Rest mit 1 bis 10 Kohlenstoffatomen, R2 Wasserstoff, einen Alkylrest mit 1 bis 3 Kohlenstoffatomen, Fluor oder einen Methoxyrest, R3 einen aliphatischen Rest mit 2 bis 20 Kohlenstoffatomen, einen cyclo- oder bicycloaliphatischen Rest mit 5 bis 7 Kohlenstoffatomen oder einen Halogenakylrest mit 3 bis 10 Kohlenstoffatomen, R4 und R5 jeweils unabhängig voneinander Wasserstoffe Chlor, Brom, Nitro oder Acetyl und X Chlor oder Brom be- .deuten, in einfacher Weise und guten Ausbeuten erhält, wenn man ein Phenylhalogenid der Formel
worin R1, R2 und X die oben angegebenen Bedeutungen haben in Gegenwart eines sauren Katalysators mit einem Alkohol der Formel R30H oder einem Alkylhalogenid der Formel R3Hal, wobei Hal ein Halogenatom bedeutet, oder einem der Verbindung R3H entsprechenden Olefin umsetzt, wobei R3 die oben genannten Bedeutungen hat und gegebenenfalls das so erhaltene Umsetzungsprodukt zu dem entsprechenden Halogenderivat, Nitroderivat oder Acetylderivat umsetzt.
[0003] Die nach diesem Verfahren erhältlichen substituierten Phenylpropylhalogenide können beispielsweise mit gegebenenfalls substituierten Morpholinen oder Piperidinen zu Verbindungen umgesetzt werden, die eine gute fungizide Wirkung haben und als Fungizid zur Bekämpfung von Pilzen verwendet werden können (DE-OS 2 656 747, 2 752 135).
[0004] Insbesondere die substituierten Phenylpropylhalogenide der allgemeinen Formel
in der R1 Wasserstoff oder einen aliphatischen Rest mit 1 bis 10 Kohlenstoffatomen,
[0006] R3 einen aliphatischen Rest mit 2 bis 20 Kohlenstoffatomen, einen cyclo- oder bicycloaliphatischen Rest mit 5 bis 7 Kohlenstoffatomen oder einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen,
[0007] R4 und R5 jeweils unabhängig voneinander Wasserstoff, Chlor, Brom, Nitro oder Acetyl und X Chlor oder Brom bedeutet, mit der Maßgabe, daß R3 einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatcmen bedeutet, wenn R2, R4 und R5 gleichzeitig Wasserstoff bedeuten, sind für die Herstellung von fungiziden Wirkstoffen entsprechend der oben beschriebenen Umsetzung gut geeignet.
[0008] Beispielsweise erhält man durch Umsetzung von 3-[-p-(1- chlormethyl-1-methyl-ethyl)-phenyl]-2-methyl-propylchlorid mit cis-2,6-Dimethylmorpholiin das N-[3-(p-1-chlormethyl-1-methyl-ethyl-phenyl)-2,6-cis- dimethylmorpholin entsprechend der folgenden Arbeitsweise: Eine Mischung von 24 g 3-p-(1-chlormethyl-1-methyl-ethylphenyl)-2-methyl-propylchlorid und 32 g cis-2,5-Dimethylmorpholin wird 4 Stunden auf 150°C erhitzt. Das Rohprodukt wird in Chloroform gelöst, die Lösung mehrfach mit Wasser gewaschen, über Na2SO4 getrocknet, das Lösungsmittel abgedampft und der Rückstand destilliert. Man erhält so 21 g N-[3-(p-1-chlormethyl-1-methyl-ethyl-phenyl)-2-methyl]-propyl-2,5-cis-dimethyl-morpholin, Kp0,1 165 - 166°C.
[0009] R1 bedeutet beispielsweise Wasserstoff, einen Methyl-, Ethyl-, Propyl-, Isopropyl-, 1-Methyl-propyl, 2-Methyl-propyl-, Butyl-, Pentyl- oder Hexylrest. R2 bedeutet beispielsweise Wasserstoff, Fluor, einen Methyl-, Äthyl-, Propyl- oder einen Methoxyrest.
[0010] R3 bedeutet beispielsweise einen tert.-Butyl-, tert.-Amyl-, 1-Ethyl-1-methyl-propyl-, 1,1-Diethyl-propyl-, 1,1-Dimethyl-butyl-, 1,1-Dimethyl-pentyl-, Cyclopentyl-, Cyclohexyl-, Cycloheptyl-, Norbornyl-, 1-Chlormethyl-l-methyl-ethyl- oder einen 3-Chlor-1,1-dimethyl-propylrest.
[0011] Als Ausgangsverbindungen für das Verfahren dienen Phenylpropylhalogenide der Formel
in der R13 R2 und X die oben genannten Bedeutungen haben, die nach folgendem Schema nach allgemein bekannten Reaktionen zugänglich sind:
[0013] Weitere Ausgangsstoffe sind Olefine, die der Verbindung R3H entsprechen, wobei R3 die oben genannten Bedeutungen hat. Dies sind beispielsweise: Äthylen, n-Penten-(1), n-Fiexen-(1), n-Hepten-(1), n-Octen-(1), n-Nonen-(1), n-Decen-(1), n-Undecen-(1), n-Dodecen-(l), Propylen-(1), n-Buten-(1); vorgenannte Alkene, die in 2-Stellung oder 3-Stellung oder 4-Stellung durch die Methyl-, Äthyl-, n-Propyl-, Isopropyl-, n-Butyl'-, Isobutyl-, sek.-Butyl-, tert.-Butyl-Gruppe substituiert sind; 2,3-Dimethyl-n-buten, 3,3-Dimethyl-n-buten, 2,5-Dimethylhepten, 3,3-Dimethylhepten, 2,3,4-Trimethylhepten, 2,4-Dimethylhepten, 2,3-Dimethylhepten, 4,4-Dimethylhepten, 2,3-Diäthylhexen, 4,4-Dimethylhexen, 2,3-Dimethylhexen, 2,4-Dimethylhexen, 2,5-Dimethylhexen, 3,3-Dimethylhexen, 3,4-Dimethylhexen, 2-Methyl-3-äthylpenten, 3-Methyl-3-äthylpenten, 2,3,3-Trimethylhepten, 2,4,4-Trimethylpenten, 2,3,3-Trimethylpenten, 2,3,4-Trimethylpenten, 2,3,3,4-Tetramethylpenten; analoge Alkene, deren Doppelbindung in 2-Stellung oder in 3-Stellung im Molekül liegen; verzweigte Alkene, wie sie in Gestalt von Gemischen bei der Dimerisierung von Isobutylen oder n-Buten (Octene) oder Trimerisierung von Isobutylen oder n-Buten (Dodecene) oder Propylen (Nonene) bzw. Tetramerisierung von Propylen (Dodecene) anfallen; die cyclischen und bicyclischen Olefine: Cyclohepten, Cyclohexen, Cyclopenten, Norbornen sowie die halogenierten Olefine: Vinylbromid, Allylchlorid, Allylbromid, 1,3-Dichlorpropen, Methylallylchlorid, Crotylchlorid, 1,3-Di- chloro-2-methyl-1-propen, 2-Methyl-allylchlorid, 2-Chlormethyl-allyl-chlorid und 4-Chlor-2-methyl-buten-1.
[0014] Bevorzugt werden: Norbornen, Cyclopenten, Cyclohexen, Cyclohepten, Isobutylen, 1-Hepten und Methallylchlorid.
[0015] Alternativ können Halogenide der Formel R3Hal als Ausgangsstoffe verwendet werden, beispielsweise die folgenden Verbindungen: Äthylbromid, n-Propylchlorid, n-Propylbromid, Isopropylchlorid, Isopropylbrcmid, n-Butylchlorid, s-Butylchlorid, Isobutylchlorid, t-Butylchlorid, Isoamylchlorid, t-Amylchlorid, t-Amylbromid, Neopentylchlorid, 1,1-Diethyl-ethylchlorid, 1,1-Diethyl-propylchiorid, 1,1-Dimethyl-butylchlorid, 1,1-Dimethylpentylchlorid, 1,3-Dichlor-1,1-dimidethylpropan, Cyclopentylchlorid, 2-Chloro-2-methylpentan, 3-Chloro-3-methylpentan, Cyclohexylchlorid, 3-Chloro-2-methylhexan, 3-Chloro-3-äthyl-pentan, 2,4-Dimethyl-2-chlöropentan, 3-Methylcyclohexylchlorid, 4-Chloro-4-methylheptan, 2-Chloro-2,5-dimethylhexan, 3-Chloro-3-äthylhexan, 4-Chloro-4-äthylheptan, 3-Chloro-3,6-dimethylheptan, 3-Chloro-3-äthyl-5-methylhexan, 4-Chloro-4n-propylheptan, 4-Chloro-2,4,6-trimethylheptan, Methylchlorid, 4-Chloro-4n-propyl-2-methylheptan, 5-Phenyl-1-chloropentan, 5-Chloro-2,5,8-trimethylnonan, 5-Chloro-2,8-dimethyl-5-äthylnonan, 5-Chloro-2,8-dimethyl-5n-propylnonan, 5-Chloro-2,8-dimethyl-5-isobutylnonan, n-Octadecylbromid, 1,3-Dichlor-1,1-dimethylpropan und 1,2,3-Trichlor-1,1-dimethylpropan. Bevorzugt werden: tert.-Butylchlorid, tert.-Amylchlorid, 1,1-Diethyl-ethylchlorid, 1,1-Diethyl-propylchlorid, 1,1-Dimethylbutylchlorid, 1,1-Dimethyl-pentylchlorid und 1,3-Dichlor-1,1-dimethylpropan.
[0016] Alternativ können Alkohole der Formel R3OH, beispielsweise die folgenden Alkohole verwendet werden: Methanol, Äthanol, n-Propylalkohol, Isopropylalkohol, n-Butanol, s-Butanol, Isobutanol, t-Butanol, n-Amylalkohol, 2-Pentanol, 3-Methyl-2-butanol, t-Amylalkohol, Neopentylalkohol, Cyclobutylcarbinol, 2-Methyl-2-pentanol, 2,3-Dimethyl-2-butanol, Cyclohexanol, Cyclopentylcarbinol, Cyclohexylcarbinol, n-Octylalkohol, 2-Methyl-2-heptanol, 2,3-Dimethyl-2-hexanol, 2,4-Dimethyl-2-hexanol, 3-Äthyl-2-methyl-2-pentanol, 2,3,3-Trimethyl-2-pentanol, 2,4,4-Trimethyl-2-pentanol, α-Phenylpropanol, α-Dodecylalkohol. Bevorzugt werden: tert.-Butanol und t-Amylalkohol.
[0017] Als saure Katalysatoren können beispielsweise verwendet werden: AlCl3, AlBr3, FeCl3, TiCl4, ZrCl4, VCl4 ZnCl2, ZnCl2 · Al2O3, ZnCl2 · SiO2 HF3, BF3 · 2 H2O, BF3 · H2SO4, BF3 · H3PO4, HBr, H2SO4, H3PO4, HF, FS03H, HF, FSO3H, P2O5, Polyphosphorsäure, SiO2 · Al2O3, CH3SO3H oder Homologe, ClSO3H, HClO4, Toluolsulfonsäure, organische sulfonsaure Kationenaustauscher.
[0019] Der saure Katalysator liegt bei der Umsetzung beispielsweise in einer Menge von 5 bis 100 Gewichtsprozenten bezogen auf das Ausgangsprodukt Phenylpropylhalogenid vor. Die Umsetzung verläuft beispielsweise bei einer Temperatur von -10° bis 250°C, vorzugsweise bei 5 - 50°C, bei Normaldruck oder erhöhtem Druck. Die Reaktion läuft nach folgender Gleichung ab:
[0020] Die Umsetzung kann beispielsweise wie folgt durchgeführt werden: Zum Gemisch aus Katalysator und Halogenid, gegebenenfalls zusammen mit einem Lösungsmittel, wird das Alkylierungsmittel zugegeben. Nach Ende der Umsetzung wird das Rohprodukt nach Abtrennung des Katalysators gegebenenfalls in einem organischen Lösungsmittel aufgenommen, mit Wasser gewaschen und destilliert.
[0021] Als organische Lösungsmittel sind beispielsweise geeignet: CFiCl3, Dichloräthan, Ligroin, Cyclohexan, CH2Cl2, CS2, Nitrobenzol, Chlorbenzol und Dichlorbenzol.
[0022] Die so erhaltenen alkylsubstituierten Phenylpropylhalogenide können gegebenenfalls in weiteren Reaktionsstufen entsprechend dem folgenden Schema, in dem R1, R2, R3, R4, R5 und X die oben genannten Bedeutungen haben,
zu den entsprechenden Halogen-, Nitro- oder Acetylderivaten umgesetzt werden. Die Halogenierung erfolgt beispielsweise in üblicher Weise durch Umsetzung mit einem Halogen und Eisenpulver. Die Nitrierung erfolgt beispielsweise in üblicher Weise durch Umsetzung mit einer Mischung aus Schwefelsäure und Salpetersäure. Die Acetylierung erfolgt beispielsweise entsprechend G. Baddelay, J. Chem. Soc. 1956, 4647.
Beispiel I
Herstellung von 3-(4-tert.-Butylphenyl)-propylchlorid
[0024] In eine Mischung von 62 Gewichtsteilen 3-Phenylpropylchlorid und 13 Gewichtsteilen 96 %iger (Gew.%) Schwefelsäure werden bei 10°C 23 Gewichtsteile Isobutylen eingeleitet. Bei Raumtemperatur (20°C) wird 3 3tunden weitergerührt. Das Rohprodukt wird in CHCl3 gelöst, mit Eiswasser gründlich gewaschen, über Na2CO3 getrocknet und destilliert.
Beispiel II
Herstellung von 3-(4-Cyclopentylphenyl)-prcpylbrcmid
[0027] Zu einer Mischung von 30 Gewichtsteilen p-Phenylpropylbromid und 20 Gewichtsteilen 96 %iger Schwefelsäure werden 10 Gewichtsteile Cyclopenten bei 10°C zugetropft. Bei Raumtemperatur (20°C) wird 14 Stunden nachgerührt. Das Rohprodukt wird in CHC13 gelöst, mit Eiswasser gründlich gewaschen, über Na2C03 getrocknet und destilliert. Man erhält 25 Gewichtsteile 3-(4-Cyclopentylphenyl)-propylbromid. Kp0,5 160 - 163°C, Ausbeute 60 % (bezogen auf 3-Phenylpropylbromid).
Beispiel III
Herstellung von 3-(4-Cyclohexylphenyl)-propylbromid
[0028] Zu einer Mischung von 40 Gewichtsteilen 3-Phenylpropylbromid und 20 Gewichtsteilen 96 %iger Schwefelsäure werden 17 Gewichtsteile Cyclohexen bei +10°C zugetropft. Bei Raumtemperatur wird 14 Stunden nachgerührt. Das Rohprodukt wird in CHCl3 gelöst, mit Eiswasser gründlich gewaschen, über Na2CO3 getrocknet und destilliert. Man erhält 35 Gewichtsteile 3-(4-Cyclohexylphenyl)-propylbromid).
Beispiel IV
Herstellung von 3-(4-Cyclohexylphenyl)-propylchlorid
[0029] Zu einer Mischung aus 31 Gewichtsteilen 3-Phenylpropylchlorid und 20 Gewichtsteilen 96 %iger Schwefelsäure werden 16,5 Gewichtsteile Cyclohexen bei +10°C zugetropft. Bei Raumtemperatur wird 14,Std. nachgerührt. Das Roh- produkt wird in CHCl3/Eiswasser gelöst, mit Eiswasser gründlich gewaschen, über Na2CO3 getrocknet und destilliert. Man erhält 27 Gewichtsteile 3-(4-Cyclohexylphenyl)-propylchlorid, Kp0,2 126 - 130°C, Ausbeute 57 % (bezogen auf 3-Phenylpropylchlorid).
Beispiel V
Herstellung von 3-(4-Norbornylphenyl)-propylchlorid
[0030] Zu einer Mischung aus 46 Gewichtsteilen 3-Phenylpropylchlorid und 30 Gewichtsteilen 96 %iger Schwefelsäure werden 28 Gewichtsteile geschmolzenes Norbornen bei 10°C zugetropft. Bei Raumtemperatur wird 14 Std. nachgerührt. Das Rohprodukt wird in CHC13 gelöst, mit Eiswasser gründlich gewaschen, über Na2CO3 getrocknet und destilliert.. Man erhält 61 Gewichtsteile 3-(4-Norbonyl-phenyl)-propylchlorid, Kp0,1 160 - 164°C, Ausbeute 81 % (bezogen auf 3-Phenylpropylchlorid).
Beispiel VI
Herstellung von 2-Methyl-3-(4-Norbornylphenyl)-propylchlorid
[0031] Zu einer Mischung aus 42 Gewichtsteilen 2-Methyl-3-phenylpropylchlorid und 22 Gewichtsteilen 96 %iger Schwefelsäure werden 24 Gewichtsteile geschmolzenes Norbornen bei 10°C zugetropft. Bei Raumtemperatur wird 14 Std. nachgerührt. Das Rohprodukt wird in CHCl3 gelöst, mit Eiswasser gründlich gewaschen, über Na2CO3 getrocknet und destilliert. Man erhält 50 Gewichtsteile 2-Methyl-3-(4-Morbornylphenyl)-propylchlorid, Kp0,1 128 - 130oC, Ausbeute 76 % (bezogen auf 2-Methyl-3-phenylpropylchlorid).
Beispiel VII
[0032] Herstellung von 3-(4-Cyclohexylphenyl)-2-methylpropyl- chlorid Zu einer Mischung aus 67 Gewichtsteilen 2-Methyl-3-phenylpropylchlorid und 40 Gewichtsteilen 96 %iger Schwefelsäure werden 33 Gewichtsteile Cyclohexen bei 10°C zugetropft. Bei Raumtemperatur wird 14 Std. nachgerührt. Das Rohprodukt wird in CHC13 gelöst, mit Eiswasser gründlich gewaschen, über Na2CO3 getrocknet und destilliert. Man erhält 70 Gewichtsteile 3-(4-Cyclohexyl- phenyl)-2-methyl-propylchlorid, Kp0,1 130-2°C, Ausbeute 70 % (bezogen auf 2-Methyl-3-phenylpropylchlorid).
Beispiel VIII
Herstellung von 3-(4-Heptylphenyl)-2-methylpropylchlorid
[0033] Zu einer Mischung aus 42 Gewichtsteilen 2-Methyl-3-phenylpropylchlorid und 20 Gewichtsteilen 96 %iger Schwefelsäure werden 25 Gewichtsteile Hepten-1 bei 10°C zugetropft. Bei Raumtemperatur wird 14 Std. nachgerührt. Das Rohprodukt wird in CHCl3 gelöst, mit Eiswasser gewaschen, über Na2CO3 getrocknet und destilliert. Man erhält 50 Gewichtsteile 3-(4-Heptylphenyl)-2-methyl-propylchlorid, Kp0,1 114-7°C, Ausbeute 75 % (bezogen auf 2-Methyl-3-phenylpropylchlorid).
Beispiel IX
Herstellung von 3-p-(1-Chlormethyl-1-methyl-äthyl) - phenyl-2-methyl-propylchlorid
[0034] Zu einer Mischung aus 17 Gewichtsteilen 2-Methyl-3-phenylpropylchlorid und 10 Gewichtsteilen 96 %iger Schwefelsäure werden 9 Gewichtsteile 2-Methylallylehlorid bei 10°C zugetropft. Bei Raumtemperatur wird 14 Std. nachgerührt, das Rohprodukt wird in CHC13 gelöst, mit Wasser gewaschen, über Na2C03 getrocknet und destilliert. Man erhält 14 Gewichtsteile 3- p-(1-Chlormethyl-1-methyl-äthyl) -phenyl-2-methyl-propylchlorid, Kp0,1 129 - 131°C, Ausbeute 54 (bezogen auf 2-Methyl-3-phenyl-propylchlorid).
Beispiel X
[0035] Herstellung von 2-Methyl-3-(p-tert.-butylphenyl)-propylchlorid durch Alkylierung von 2-Methyl-3-phenyl-propylchlorid nach verschiedenen Methoden A) Konzentrierte Schwefelsäure und Isobutylen In eine Mischung aus 84 Gewichtsteilen 2-Methyl-3-phenylpropylchlorid und 12,8 Gewichtsteilen 96 %iger Schwefelsäure werden bei +10°C 31 Gewichtsteile Isobutylen eingeleitet. Anschließend wird 3 Stunden lang bei 10°C weitergerührt. Danach läßt man die Mischung sich auf Raumtemperatur (20°C) erwärmen, trennt die Schwefelsäurephase ab und wäscht die organische Phase mit 100 Volumenteilen 20 %iger Natronlauge. Zur besseren Phasentrennung werden 50 Volumenteile Aceton zugegeben. Danach wird die organische Phase abgetrennt und destilliert.
[0036] Man erhält 16 Gewichtsteile 2-Methyl-3-phenyl-propylchlorid, Kp16 = 105°C und 75 Gewichtsteile 2-Methyl-3-(p-tert.-butylphenyl)-propylchlorid, Kp0,02 = 80 - 81°C Der Umsatz beträgt 81 %, die Ausbeute 82,5 % d. Th. (bez. auf umgesetztes 2-Methyl-3-phenyl-propylchlorid).
[0037] B) Wasserfreies FeCl3 und Isobutylen Bei 10°C werden zu 84 Gewichtsteilen 2-Methyl-3-phenylpropylchlorid 20,3 Gewichtsteile feinteiliges wasserfreies Eisen-(III)-chlorid gegeben. Anschließend werden in dieses Gemisch bei 10°C 31 Gewichtsteile Isobutylen eingeleitet, nach beendetem Einleiten wird 3 Stunden bei 10°C nachgerührt. Dann läßt man die Mischung sich auf Raumtemperatur erwärmen, gibt unter Rühren und Kühlung 100 Volumenteile Wasser hinzu und filtriert vom Festprodukt ab.
[0038] Das Filtrat besteht aus einer wäßrigen und einer organischen Phase. Die organische Phase wird abgetrennt und destilliert.
[0039] Man erhält 5 Gewichtsteile 2-Methyl-3-phenyl-propylchlorid, Kp16 = 105°C und 74,5 Gewichtsteile 2-Methyl-3-(p-tert.-butylphenyl)-propylchlorid, Kp0,02 = 80 - 81°C
[0040] Der Umsatz beträgt 94 %, die Ausbeute 70 % d. Th. (bez. auf umgesetztes 2-Methyl-3-phenyl-propylchlorid).
[0041] C) Bortrifluorid und tert.-Butylchlorid In eine Mischung aus 84 Gewichtsteilen 2-Methyl-3-phenyl-propylchlorid und 50 ml BF3· 2 H20 wird bei Raumtemperatur 30 Minuten lang BF3 eingeleitet. Anschließend werden 56 Gewichtsteile tert.-Butylchlorid bei Raumtemperatur zugetropft. Die Mischung wird 4 Std. lang zum Rückfluß erhitzt. Man läßt abkühlen, gibt das Rohprodukt in Wasser und extrahiert es mit Chloroform. Die organische Phase wird abgetrennt, mit Wasser gewaschen, über Na2CO3 getrocknet und destilliert. Man erhält 30 Gewichtsteile 2-Methyl-3-phenyl-propylchlorid, Kp16 = 105°C und 45 Gewichtsteile 2-Methyl-3-(p-tert.-butylphenyl)-propylchlorid Kp0,02 = 80 - 81°C
[0042] Der Umsatz beträgt 64 %, die Ausbeute 63 % bezogen auf umgesetztes 2-Methyl-3-phenylpropylchlorid.
[0043] D) Fluorwasserstoff und Isobutylen In eine Mischung aus 68 Gewichtsteilen 2-Methyl-3-phenylpropylchlorid und 3 Gewichtsteilen Fluorwasserstoff werden bei 0°C 20 Gewichtsteile Isobuten eingeleitet. Anschließend wird 12 Std. lang bei Raumtemperatur gerührt. Das Rohprodukt wirdrmit Wasser gewaschen, über Na2CO3 getrocknet und destilliert. Man erhält 36 Gewichtsteile 2-Methyl-3-phenylpropylchlorid Kp16 = 105°C und 32 Gewichtsteile 2-Methyl-3-(p-tert.-butylphenyl)-propylchlorid Kp0,02 = 80 - 81°C.
[0044] Der Umsatz beträgt 47 %, die Ausbeute 75 % bezogen auf umgesetztes 2-Methyl-3-phenylprcpylchlorid.
[0045] E) Eisen-(III)-chlorid und tert.-Butylchlorid In eine Mischung aus 100 Gewichtsteilen 2-Methyl-3-phenyl-propylchlorid und 8,1 Gewichtsteilen feinteiligem. Eisen-(III)-chlorid (wasserfrei) werden bei 30°C 61 Gewichtsteile tert.-Butylchlorid zugetropft. Bei Raumtemperatur wird 14 Std. nachgerührt. Das Rohprodukt wird in Eiswasser gegossen und mehrfach mit CHCl3 extrahiert, die Chloroformlösung abgetrennt, mit Na2CO3 getrocknet und destilliert.
[0046] Man erhält 42 Gewichtsteile 2-Methyl-3-phenyl-propylchlorid Kp16 105°C und 55 Gewichtsteile 2-Methyl-3-(p-tert.-butylphenyl)-propylchlorid, Kp0,02 = 80 - 82°C.
[0047] Der Umsatz beträgt 58 %, die Ausbeute 71 %, bezogen auf umgesetztes 2-Methyl-3-phenyl-propylchlorid.
Beispiel XI
[0048] Herstellung von 3-(5-tert.-Butyl-2-methoxy-phenyl)-2-methyl-propylchlorid Zu einer Mischung aus
[0049] 234 Gewichtsteilen 3-(2-Methoxy-phenyl)-2-methyl-propylchlorid und 19,4 Gewichtsteilen Eisen-(III)-chlorid (wasserfrei) werden bei 30°C 122 Gewichtsteile tert.-Butylchlorid zugetropft. Man rührt 8 Std. bei 50°C und 14 Std. bei Raumtemperatur. Das Rohprodukt wird in Eiswasser gegossen, in CHCl3 gelöst, mehrfach mit Wasser gewaschen, über Na2CO3 getrocknet, das Lösungsmittel verdampft und der Rückstand destilliert.
[0050] Man erhält 110 Gewichtsteile 3-(5-tert.-Butyl-2-methoxyphenyl)-2-methyl-propylchlorid, Kp0,1 = 105 - 108°C
Beispiel XII
[0051] Herstellung von 3-(5-tert.-Butyl-2-methyl-phenyl)-2-methyl-propylchlorid und von 3-(4-tert.-Butyl-2-methylphenyl)-2-methyl-propylchlorid In eine Mischung aus 200 Gewichtstellen 3-(2-Methylphenyl)-2-methyl-propylchlorid und 98 Gewichtsteilen 96 %iger Schwefelsäure werden bei +10°C 62 Gewichtsteile Isobutylen eingeleitet. Anschließend wird 3 Std. bei 10°C nachgerührt. Man läßt die Mischung sich auf Raumtemperatur erwärmen, trennt die Schwefelsäurephase ab und wäscht die organische Phase mit 100 Volumenteilen 20 %iger Natronlauge. Zur besseren Phasentrennung werden 50 Volumenteile Aceton zugegeben. Danach wird die organische Phase abgetrennt und destilliert.
[0052] Man erhält ein Gemisch bestehend aus 3-(5-tert.-Butyl-2-methyl-phenyl)-2-methyl-propylchlorid und 3-(4-tert.-Butyl-2-methyl-phenyl)-2-methyl-propyl-chlorid. Kp0,1= = 106°C.
Beispiel XIII
[0053] Herstellung von 3-[p-(1-Methyl-1-äthyl-propyl)-phenyl]-2-methyl-propylchlorid Zu einer Mischung aus 510 Gewichtsteilen 2-Methyl-3-phenyl-propylchlorid und 49 Gewichtsteilen Eisen-(III)-chlorid (wasserfrei) werden bei 30°C 365 Gewichtsteile 1-Methyl-1-äthyl-propylchlorid zugetropft. Man rührt 8 Std. bei 50°C und 14 Std. bei Raumtemperatur (20°C). Das Rohprodukt wird in Eiswasser gegossen, in CHCl3 ge- löst, mehrfach mit Wasser gewaschen, über Na2CO3 ge-trocknet, das Lösungsmittel verdampft und der Rückstand destilliert.
[0054] Man erhält 420 Gewichtsteile 3-[p-(1-Methyl-1-äthyl- propyl)-phenyl]-2-methyl-propylchlorid. Kp0,1 = 125°C
Beispiel XIV
[0056] Zu einer Mischung aus 23 Gewichtsteilen 3-(p-tert.-Butyl-phenyl)-2-methyl-propylchlorid und 0,5 Gewichtsteilen Eisenpulver werden 16 Gewichtsteile Brom zugetropft. Die Reaktionstemperatur steigt dabei auf 35°C an. Man rührt 17 Std. nach, löst in Chloroform, wäscht die Lösung mit Wasser, mit wäßriger NaHCO3-Lösung und wieder mit Wasser, trocknet über Na2SO4, verdampft das Lösungsmittel und destilliert den Rückstand.
[0057] Man erhält 20 Gewichtsteile 3-(p-tert.-Butyl-o-bromphenyl)-2-methyl-propylchlorid). Kp0,1 111 - 115°C
Beispiel XV
[0058] Herstellung von 3-(p-tert.-Butyl-o-chlorphenyl)-2-nethyl- propylchlorid und 3-(p-tert.-Butyl-m-chlor-phenyl)-2-methyl-propylchlorid
[0059] Zu einer Mischung aus 320 Gewichtsteilen 3-(p-tert.-Butylphenyl)-2-methyl-propylchlorid und 2 Gewichtsteilen Eisenpulver werden bei 30 - 35°C 101 Gewichtsteile Chlor eingegast. Man rührt 1 Std. nach und gießt das Rohprodukt in Eiswasser. Die organische Phase wird mit Wasser, wäßriger NaHCO3-Lösung und wieder mit Wasser gewaschen, über Na2SO4 getrocknet, das Lösungsmittel verdampft und der Rückstand destilliert. Man erhält 300 Gewichtsteile einer Mischung aus 3-(p-tert.-Butyl-o-chlor-phenyl)-2-methyl- propylchlorid und 3-(p-tert.-Butyl-m-chlor-phenyl)-2-methyl-propylchlorid und 3-(p-tert.-Butyl-m-chlorphenyl)-2-methyl-propylchlorid Kp0,1 = 106 - 111°C
Beispiel XVI
[0060] Herstellung von 3-(p-tert.-Amyl-o-chlor-phenyl)-2-methyl- propylchlorid und 3-(p-tert.-Amyl-m-chlor-phenyl)-2-methyl-propylchlorid Zu einer Mischung aus 177 Gewichtsteilen 3-(p-tert.-Amyl- phenyl)-2-methyl-propylchlorid und 1 Gewichtsteil Eisenpulver werden bei 30 - 35°C 63 Gewichtsteile Chlor eingegast. Man rührt 14 Std. bei Raumtemperatur nach, löst in Chloroform, wäscht mit Wasser, 10 %iger Natronlauge und wieder mit Wasser, trocknet über Na2SO4, verdampft das Lösungsmittel und destilliert den Rückstand.
[0061] Man erhält 110 Gewichtsteile einer Mischung aus 3-(p-tert.-Amyl-o-chlor-phenyl)-2-methyl-propylchlorid und 3-(p-tert.-Amyl-m-chlor-phenyl)-2-methyl-propylchlorid. Kp0,1 = 118 - 120°C
Beispiel XVII
[0062] Herstellung von 3-(p-tert.-Butyl-o-nitro-phenyl)-2-methyl-propylchlorid Zu 448 Gewichtsteilen 3-(p-tert.-Butylphenyl)-2-methyl- propylchlorid wird unter Eiskühlung 440 Gewichtsteile Nitriersäure, bestehend aus 200 Gewichtsteilen konz. Salpetersäure und 240 Gewichtsteilen konz. Schwefelsäure zugetropft. Nach 3 Std. Nachrühren bei Raumtemperatur wird das Rohprodukt auf Eis gegossen, mit Diäthyläther extrahiert, mit Wasser, wäßriger NaHC03-Lösung und wieder Wasser gewaschen, über Na2SO4 getrocknet, verdampft das Lösungsmittel und destilliert den Rückstand.
[0063] Man erhält 413 Gewichtsteile 3-(p-tert.-Butyl-o-nitrophenyl)-2-methyl-propylchlorid. Kp0,1 = 138 - 140°C
Beispiel XVIII
[0064] Herstellung von 2-Methyl-3-(o-acetyl-p-tert.-butylphenyl)-propylchlorid Zu einer Lösung von 60 g 3-(p-tert.-Butyl-phenyl)-2-methyl- propylchlorid in 50 ml Methylenchlorid wird bei 20°C eine Lösung von 63 g Acetylchlorid und 53 g Aluminiumchlorid in 300 ml Methylenchlorid zugetropft. Nach 10 Minuten Nachrühren bei Raumtemperatur wird die Mischung in Eiswasser gegossen, mit Methylenchlorid extrahierte mehrfach mit Wasser gewaschen, über Na2SO4 getrocknet, man verdampft das Lösungsmittel und destilliert den Rückstand.
Beispiel XIX
[0066] Darstellung von 3-(p-tert.-Butyl-o-chlor-phenyl)-2-methyl-propylbromid (1) und 3-(p-tert.-Butyl-m-chlorphenyl)-2-methyl-propylbromid (2)
Beispiel XX
[0068] 3-[p-(1,1-Dimethyl-butyl)-phenyl]-2-methyl-propylchlorid Die Herstellung erfolgt analog Beispiel XE. Kp0,1 116 - 118°C
Beispiel XXI
[0069] 3-[p-(1-Äthyl-1-methyl-propyl)-o-chlor-phenyl]-2-methyl- propylchlorid und 3-[p-(1-Äthyl-1-methyl-propyl)-m-chlorphenyl]-2-methyl-propylchlorid
Beispiel XXII
[0071] 3-(p-Methoxy-o-tert.-amyl-phenyl)-2-methyl-propylchlorid und 3-(p-Methoxy-m-tert.-amyl-phenyl)-2-methyl-propylchlorid Die Herstellung erfolgt analog Beispiel XE. Kp0,1 = 123 - 125°C
Beispiel XXIII
1. Verfahren zur Herstellung von Phenylpropylhalogeniden der allgemeinen Formel
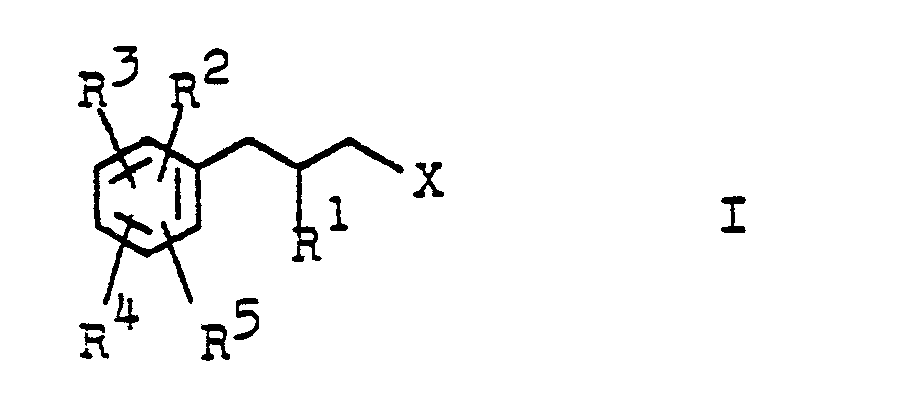
in der R1 Wasserstoff oder einen aliphatischen Rest mit 1 bis 10 Kohlenstoffatomen, R2 Wasserstoffe einen Alkylrest mit 1 bis 3 Kohlenstoffatomen, Fluor oder einen Methoxyrest, R3 einen aliphatischen Rest mit 2 bis 20 Kohlenstoffatomen, einen cyclo- oder bicycloaliphatischen Rest mit 5 bis 7 Kohlenstoffatomen oder einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen, R4 und R5 jeweils unabhängig voneinander Wasserstoff, Chlor, Brom, Nitro oder Acetyl und X Chlor oder Brom bedeuten, dadurch gekennzeichnet, daß man ein Phenylpropylhalogenid der Formel
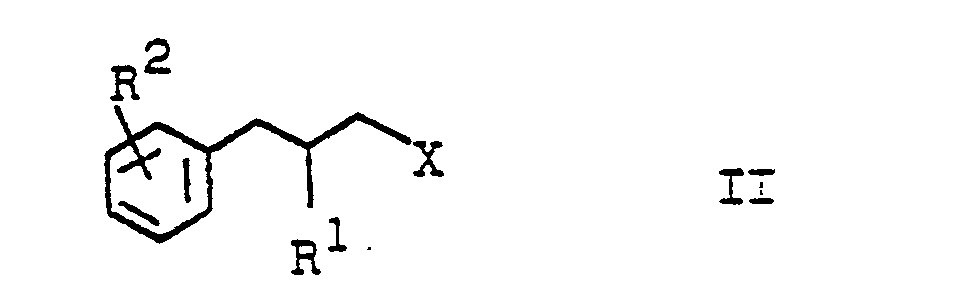
worin R1, R2 und X die oben angegebenen Bedeutungen haben in Gegenwart eines sauren Katalysators mit einem Alkohol der Formal R3OH oder einen Alkylhalogenid der Formel R3 Hal, wobei Hal ein Halogenatom bedeutet, oder einem der Verbindung R3H entsprechendem Olefin umsetzt, wobei R3 die eben genannten Bedeutungen hat und gegebenenfalls das so erhaltene Umsetzungsprodukt zu dem entsprechenden Halogenderivat, Nitroderivat oder Acetylderivat umsetzt.
in der R1 Wasserstoff oder einen aliphatischen Rest mit 1 bis 10 Kohlenstoffatomen, R2 Wasserstoffe einen Alkylrest mit 1 bis 3 Kohlenstoffatomen, Fluor oder einen Methoxyrest, R3 einen aliphatischen Rest mit 2 bis 20 Kohlenstoffatomen, einen cyclo- oder bicycloaliphatischen Rest mit 5 bis 7 Kohlenstoffatomen oder einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen, R4 und R5 jeweils unabhängig voneinander Wasserstoff, Chlor, Brom, Nitro oder Acetyl und X Chlor oder Brom bedeuten, dadurch gekennzeichnet, daß man ein Phenylpropylhalogenid der Formel
worin R1, R2 und X die oben angegebenen Bedeutungen haben in Gegenwart eines sauren Katalysators mit einem Alkohol der Formal R3OH oder einen Alkylhalogenid der Formel R3 Hal, wobei Hal ein Halogenatom bedeutet, oder einem der Verbindung R3H entsprechendem Olefin umsetzt, wobei R3 die eben genannten Bedeutungen hat und gegebenenfalls das so erhaltene Umsetzungsprodukt zu dem entsprechenden Halogenderivat, Nitroderivat oder Acetylderivat umsetzt.
2. Phenylpropylhalogenide der allgemeinen Formel
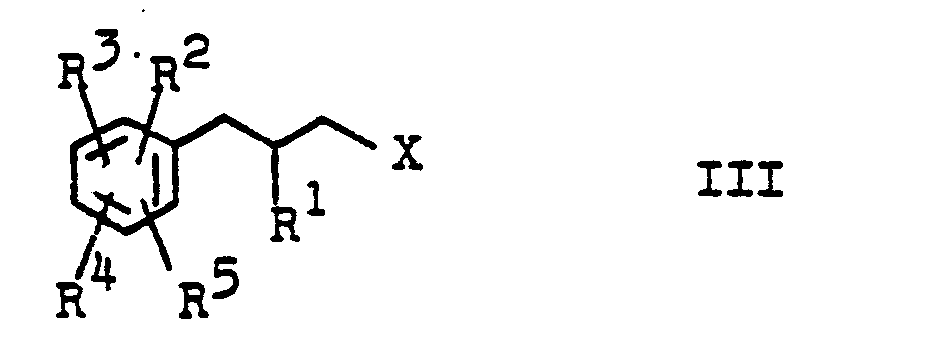
in der R1 Wasserstoff oder einen aliphatischen Rest mit 1 bis 10 Kohlenstoffatomen, R2 Wasserstoff, einen Alkylrest mit 1 bis 3 Kohlenstoffatomen, Fluor oder einen Methoxyrest, R3 einen aliphatischen Rest mit 2 bis 20 Kohlenstoffatomen, einen cyclo- oder bicycloaliphatischen Rest mit 5 bis 7 Kohlenstoffatomen oder einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen, R4 und R5 jeweils unabhängig voneinander Wasserstoff, Chlor, Brom, Nitro oder Acetyl und X Chlor oder Brom bedeutet, mit der Maßgabe, daß R3 einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen bedeutet, wenn R2, R4 und R5 gleichzeitig Wasserstoff bedeuten.
in der R1 Wasserstoff oder einen aliphatischen Rest mit 1 bis 10 Kohlenstoffatomen, R2 Wasserstoff, einen Alkylrest mit 1 bis 3 Kohlenstoffatomen, Fluor oder einen Methoxyrest, R3 einen aliphatischen Rest mit 2 bis 20 Kohlenstoffatomen, einen cyclo- oder bicycloaliphatischen Rest mit 5 bis 7 Kohlenstoffatomen oder einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen, R4 und R5 jeweils unabhängig voneinander Wasserstoff, Chlor, Brom, Nitro oder Acetyl und X Chlor oder Brom bedeutet, mit der Maßgabe, daß R3 einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen bedeutet, wenn R2, R4 und R5 gleichzeitig Wasserstoff bedeuten.
3. Verfahren gemäß Anspruch 1, dadurch gekennzeichnet, daß man die Umsetzung mit einem
der Formel R3H entsprechenden Olefin in Gegenwart von H2SO4, HF oder FeCl3 durchgeführt, wobei R3 die in Anspruch 1 genannten Bedeutungen hat.
4. Verfahren gemäß Anspruch 1, dadurch gekennzeichnet, daß man die Umsetzung mit einem
tertiären Alkylchlorid in Gegenwart von FeCl3 durchführt.
5. Verfahren gemäß Anspruch 1, dadurch gekennzeichnet, daß man 3-(phenyl)-2-methyl-propylchlorid
mit Isobutylen in Gegenwart von konzentrierter Schwefelsäure umsetzt.
6. 3-(p.-1-Chlormethyl-1-methyl-äthyl-phenyl)-2-methyl- propylchlorid.
7. 3-(p-tert.-Butyl-o-chlor-phenyl)-2-methyl-propylchlorid .
8. 3-(p-tert.-Butyl-o-chlor-phenyl)-2-methyl-propylbromid.
9. Verwendung von Phenylpropylhalogeniden der allgemeinen Formel
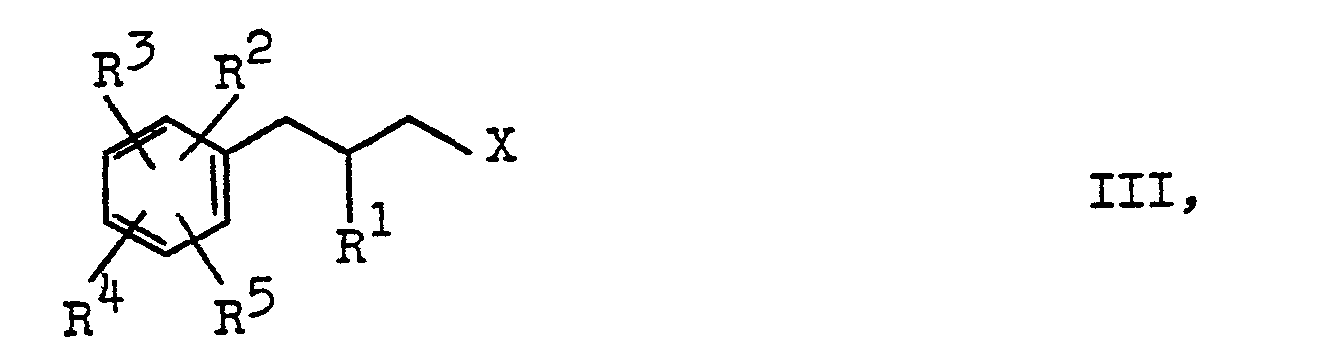
in der R1 Wasserstoff oder einen aliphatischen Rest mit 1 bis 10 Kohlenstoffatomen, R2 Wasserstoff, einen Alkylrest mit 1 bis 3 Kohlenstoffatomen, Fluor oder einen Methoxyrest, R3 einen aliphatischen Rest mit 2 bis 20 Kohlenstoffatomen, einen cyclo- oder bicycloaliphatischen Rest mit 5 bis 7 Kohlenstoffatomen oder einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen, R4 und R5 jeweils unabhängig voneinander Wasserstoff, Chlor, Brom, Nitro oder Acetyl und X Chlor oder Brom bedeutet, mit der Maßgabe, daß R3 einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen bedeutet, wenn R2, R4 und R5 gleichzeitig Wasserstoff bedeuten, zur Umsetzung mit einem gegebenenfalls substituierten Morpholin oder Piperidin.
in der R1 Wasserstoff oder einen aliphatischen Rest mit 1 bis 10 Kohlenstoffatomen, R2 Wasserstoff, einen Alkylrest mit 1 bis 3 Kohlenstoffatomen, Fluor oder einen Methoxyrest, R3 einen aliphatischen Rest mit 2 bis 20 Kohlenstoffatomen, einen cyclo- oder bicycloaliphatischen Rest mit 5 bis 7 Kohlenstoffatomen oder einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen, R4 und R5 jeweils unabhängig voneinander Wasserstoff, Chlor, Brom, Nitro oder Acetyl und X Chlor oder Brom bedeutet, mit der Maßgabe, daß R3 einen Halogenalkylrest mit 3 bis 10 Kohlenstoffatomen bedeutet, wenn R2, R4 und R5 gleichzeitig Wasserstoff bedeuten, zur Umsetzung mit einem gegebenenfalls substituierten Morpholin oder Piperidin.
