|
(11) | EP 0 422 719 A1 |
| (12) | DEMANDE DE BREVET EUROPEEN |
|
|
|
|
|||||||||||||||||||||||||||
| (54) | Biomatériau de comblement osseux ou dentaire, et procédé de préparation |
| (57) L'invention concerne un biomatériau de comblement osseux ou dentaire à base d'apatite.
Elle vise à fournir un biomatériau ayant des propriétés antiseptiques en vue de limiter
la prolifération des micro-organismes dans le site d'implantation. Le biomatériau
conforme à l'invention est à base de phosphate de calcium oxygéné ayant une structure
apatitique qui possède des espèces oxygénées à des degrés d'oxydation supérieurs ou
égaux à - 2. Ce biomatériau associe aux propriétés antiseptiques sus-évoquées, une
excellente biocompatibilité, une très faible solubilité et de bonnes qualités d'ostéo-induction.
|
[0001] L'invention concerne un biometériau de comblement osseux ou dentaire. Elle vise un biomatériau de comblement apte à favoriser une réhabitation par le tissu osseux ou dentaire et à permettre une substitution partielle ou totale du biomatériau par le tissu. L'invention s'étend à des procédés de fabrication dudit biomatériau.
[0002] On connaît des biomatériaux de comblement intraosseux ou intradentaires à base de phosphate de calcium et en particulier à base h'hydroxyapatite Ca₁₀ (PO₄)₆ (OH)₂. On pourra par exemple se reporter aux publications suivantes concernant ces biomatériaux apatitiques : "Jarcho M, Kay J.F, Gumaer KI, Doremus R.H and Drobeck H.P Tissue, cellular and subcellular events at a bone-ceramic hydroxylapatite interface. J. Bioeng 1, 79, 1977"; "Ducheyne P and de Groot K, In vivo surface activity of a hydroxyapatite alveolar bone substitute, J. Biomed. Mater. Res. 14, 225, 1980" ; "Klaas de Groot, Bioceramics of calcium phosphate, C.R.S. Press Inc., New-York, 1983".
[0003] Ces biomatériaux sont connus pour présenter ies propriétés suivantes :
- excellente biocompatibilité (risques très limités de réactions de rejets inflammatoires),
- très faible solubilité (faible tendance à disparaître dans le milieu au cours des quelques mois succédant l'implantation),
- qualité d'ostéoinduction (tendance à favoriser la reconstruction osseuse).
[0004] Ces propriétés qui rendent ce matériau très approprié à la réalisation de comblements osseux ou dentaires, proviennent de leur composition chimique et de leur structure cristallographique, qui sont voisines de celles de la partie minérale des tissus calcifiés.
[0005] Toutefois, ces biomatériaux apatitiques connus sont inactifs vis-à-vis des micro-organismes pathogènes susceptibles de se développer dans les tissus. Ainsi, ces biomatériaux ont essentiellement un rôle mécanique (remplissage et substitution osseuse) et n'ont aucune propriété antiseptique : ils sont totalement inaptes à limiter le développement des bactéries, champignons... qui sont présents avant l'intervention (caries, maladies paradontales...) ou qui en sont la conséquence (asepties imparfaites notamment en bouche, inflammations...).
[0006] La présente invention se propose de fournir un nouveau biomatériau présentant, comme les matériaux connus précités, une structure apatitique lui conférant d'excellentes qualités de biocompatibilité et d'ostéoconduction ou induction, mais qui présente des propriétés antiseptiques le rendant capable de limiter la prolifération des microorganismes dans le site d'implantation.
[0007] L'invention vise ainsi à protéger l'allogreffe de façon locale au niveau du site d'implantation, en évitant une utilisation d'antibiotiques par voie générale. Elle vise également à assurer cette protection d'une façon continue dans le temps, pendant toute la durée où le matériau reste présent dans le site d'implantation.
[0008] Un autre objectif de l'invention est de permettre, suivant le cas traité, d'adapter le champ d'action du biomatériau au caractère des micro-organismes présents ou susceptibles de se développer sur le site d'implantation (en particulier en vue de lutter de façon spécifique contre les micro-organismes anaérobies).
[0009] A cet effet, le biomatériau de comblement osseux ou dentaire conforme à l'invention comprend du phosphate de calcium oxygéné (ApO) ayant une structure apatitique possédant des expèces oxygénées à des degrés d'oxydation supérieurs ou égaux à -2, de formule :
Ca10-x □x (HPO₄)y (PO₄)6-y (OH)z (O₂²⁻)t □2-z-t (O₂)u
où □ représente une lacune,
0 ≦ x ≦ 1
0 ≦ y ≦ 1
0 ≦ t ≦ 1
0 ≦ u ≦ 1
u + t ≧ 0,2
et z = 2 + y - x - 2t
[0010] Un tel biomatériau contient dans les tunnels de sa structure apatitique au moins l'une des deux espèces suivantes : O₂²⁻, O₂. Les expérimentations ont montré que ces espèces étaient libérées dans le milieu soit par dissolution progressive du matériau, soit par échange chimique avec le milieu. L'espèce O₂²⁻ (ion peroxyde) ainsi libérée agit in situ pour détruire les micro-organismes avec une efficacité bien connue en soi pour cette espèce ; l'espèce O₂ (oxygène moléculaire) agit de façon spécifique sur les micro-organismes anaérobies en augmentant localement la pression partielle d'oxygène. Tout en conservant une structure apatitique et les propriétés afférentes de biocompatibilité et d'ostéoconduction ou induction le biomatériau conforme à l'invention engendre donc un effet de protection du site d'implantation à l'égard de toute apparition ou développement d'organismes pathogènes. La vitesse de dissolution dans le milieu et donc la durée d'efficacité du matériau peuvent être ajustées en faisant varier la stoechiométrie de la structure apatitique et notamment les coefficients x et y, le nombre de lacunes en site calcique et d'ions HPO₄ étant directement lié à la vitesse de dissolution (matériau peu soluble pour x < 0,1, y < 0,1 et de solubilité croissante pour x > 0,1 , y > 0,1).
[0012] Le biomatériau de la première sous-famille contient, à la fois, les espèces O₂²⁻ et O₂ de façon à présenter une action antiseptique générale sur les micro-organismes (présence de O₂²⁻), renforcée vis-à-vis des anaérobies (présence de O₂). Le biomatériau de cette sous-famille comprend un phosphate de calcium oxygéné (ApO) de structure apatitique dans laquelle les coefficients sont tels que :
0,1 ≦ x ≦ 0,4
y peu différent de x
t ≦
0,2 ≦ u ≦ 0,8
[0013] Il est à noter que la solubilité de ce biomatériau peut être ajustée dans une large plage depuis une faible solubilité (x de l'ordre de 0,1) jusqu'à une solubilité élevée (x de l'ordre de 0,4).
[0014] Le biomatériau de la deuxième sous-famille contient essentiellement l'espèce O₂²⁻ et simplement des traces de l'espèce O₂. Ce matériau très riche en groupement peroxyde présente une action générale antiseptique très efficace. Le biomatériau de cette sous-famille comprend un phosphate de calcium oxygéné (ApO) de structure apatitique dans laquelle les coefficients sont tels que :
0,2 ≦ x ≦ 0,5
y peu différent de x
0,8 ≦ t ≦ 1
u < 0,1
[0015] Ce matériau (issu comme on le verra d'une fabrication à basse température) possède un coefficient x supérieur à 0,2 (nombre de lacune relativement élevé) et présente donc une solubilité généralement plus importante que le matériau précédent.
[0016] Le biomatériau de la troisième sous-famille contient exclusivement l'espèce O₂ de sortie qu'il présente une action sélective très efficace vis à vis des micro-organismes anaérobies. Ce biomatériau est important en pratique car ce sont généralement des micro-organismes de ce type qui se développent en milieu d'implantation; en outre, dans certains cas, il est préférable d'eviter l'action générale de destruction de l'espèce O₂²⁻, en particulier pour préserver certains micro-organismes qui développent une action favorable. Le biomatériau de cette troisième sous-famille comprend un phosphate de calcium oxygéné (ApO) de structure apatitique suivante :
Ca₁₀₋ □x (H PO₄)y (PO₄)6-y (OH)2+y-x □1-y(O₂)u
où 0 ≦ x ≦ 0,2
0 ≦ y ≦ 0,2
0,2 ≦ u ≦ 0,8
[0017] La solubilité de ce biomatériau est généralement plus faible que celle des précédents, mais peut être ajustée à une valeur parfaitement satisfaisante pour assurer une pression locale d'oxygène suffisante. Il est à noter que, généralement, la présence de micro-organismes pathogènes engendre une baisse locale du pH qui augmente la dissolution du biomatériau et donc le dégagement d'oxygène au moment du besoin.
[0018] Le biomatériau de l'invention peut être utilisé, notamment dans le cas où les espèces actives O₂²⁻ et O₂ sont en faible teneur (t et u faibles) ou lorsque l'on se trouve sur un site à haut risque inflammatoire (intervention sur carie ou maladie osseuse telle qu'ostéomyélite). Il peut également être utilisé mélangé à d'autres matériaux de comblement connus afin d'associer les qualités propres de ces matériaux à celles antiseptiques du biomatériau conforme à l'invention ; les additifs peuvent en particulier être les suivants : phosphate de calcium apatitique non oxygéné, encore désigné par hydroxyapatite HAp de formule Ca₁₀ (PO₄)₆(OH)₂ (caractéristiques : très faible solubilité, bonne tenue mécanique et porosité élevée donnant de bonnes qualités d'ostéoconduction) ; phosphate tricalcique PTCa de formule Ca₃(PO₄)₂ (généralement à faible teneur en raison de sa forte solubilité) ; carbonate de calcium CaCO₃ (naturel ou synthétique) et/ou sulfate de calcium CaSO₄ (faible coût et prise avec expansion) ; dérivés sanguins de coagulation, en particulier fibrine, fibrinogène... ; collagène (malléabilité et adhérence) éventuellement complété de glycoaminoglycanes et de sulfate de chondroitine (action ostéoinductrice).
[0019] De plus, il est possible de substituer partiellement des ions hydrogénophosphates (HPO₄) par des ions carbonates (CO₃) dans la structure apatitique oxygénée du biomatériau conforme à l'invention. Cette substitution rapproche encore la composition du biomatériau de celle de la partie minérale de l'os, tout en conservant le caractère antiseptique au biomatériau.
[0020] L'invention s'étend à des procédés de fabrication du biomatériau conforme à l'invention permettant d'obtenir l'apatite oxygénée appropriée à chaque application, procédés permettant en particulier de fabriquer des biomatériaux conformes aux trois sous-familles définies précédemment.
[0021] Il est à noter que de l'apatite oxygénée a déjà été obtenue en laboratoire par Dale R. SIMPSON et 1969 ("D.R. SIMPSON, oxygen rich apatite, The Am. Min. vol. 54 p. 560-562, March-April 69"). D. SIMPSON a montré que ce composé était soluble dans l'acide chlorhydrique et dégageait de l'oxygène apte à oxyder à chaud une électrode en cuivre. Toutefois, cette fabrication ponctuelle de laboratoire ne permet pas d'ajuster les coefficients des diverses espèces et d'obtenir le corps que l'on désire.
[0022] Selon un premier mode de préparation conforme à l'invention, le procédé consiste à mettre en suspension un phosphate calcique du groupe suivant : phosphate tricalcique (PTCa), phosphate dicalcique (DCPD), ou phosphate octocalcique (OCP), dans une solution aqueuse contenant de l'eau oxygénée, à laisser évoluer la suspension à un pH, à une température et pendant une durée fonctions des coefficients x, y, t et u désirés, à séparer physiquement la phase solide et la phase liquide et à sécher ladite phase solide.
[0023] Selon un autre mode de préparation, le procédé consiste à verser dans une solution aqueuse contenant de l'eau oxygénée, d'une part un sel soluble de calcium, d'autre part du phosphate d'ammonium, à un pH, à une température et pendant une durée fonctions des coefficients x, y, t et u désirés, à laisser maturer le précipité obtenu dans la solution-mère, à séparer physiquement la phase solide et la phase liquide et à sécher ladite phase solide.
[0024] Le second mode de préparation sera de préférence choisi pour favoriser la teneur en ions péroxyde du biomatériau.
[0025] Pour optimiser cette préparation, et éviter la formation de phases étrangères et des pertes en réactifs, les quantités de sels de calcium et de phosphate d'ammonium versées dans la solution aqueuse d'eau oxygénée sont telles que le rapport atomique
soit compris entre 1,4 et 2.
[0026] Dans les deux modes de préparation, le pH lors de l'évolution ou de la précipitation est avantageusement fixé à une valeur comprise entre 5 et 9, d'autant plus élevée que l'on désire des coefficients x et y plus faibles dans les plages 0 ≦ x ≦ 1 et 0 ≦ y ≦ 1. De préférence le pH est ajusté par ajout d'ammoniaque, l'ion ammonium étant peu gênant et facilement éliminable.
[0027] La température lors de l'évolution ou de la précipitation est avantageusement fixée à une valeur comprise entre 20° C et 100° C, d'autant plus élevée que l'on désire des coefficients x, y et t plus faibles dans les plages 0 ≦ x ≦ 1, 0 ≦ y ≦ 1 et 0 ≦ t ≦ 1.
[0028] La durée pendant laquelle on laisse évoluer la suspension ou pendant laquelle s'effectue la précipitation est un facteur important pour obtenir, à la fois, une bonne cristallisation de l'apatite et des valeurs désirées des coefficients x, y et t.
[0029] Cette durée est avantageusement fixée à une valeur comprise entre 2 minutes et 300 heures, d'autant plus longue que l'on désire des coefficients x, y et t plus faibles dans les plages 0 ≦ x ≦ 1 et 0 ≦ y ≦ 1 et 0 ≦ t ≦ 1.
[0030] Dans le cas de la préparation par précipitation, le versement des sels de calcium et de phosphore s'effectue progressivement dans la solution d'eau oxygénée pendant la durée sus-évoquée. Pour les longues durées, ce versement est fait en goutte à goutte avec un débit approprié.
[0031] La concentration en eau oxygénée de la solution aqueuse joue sur les teneurs en O₂²⁻ et en O₂. De préférence, on choisit une solution aqueuse d'eau oxygénée de concentration comprise entre 5 et 50 volumes, d'autant plus élevée que l'on désire des coefficients t et u plus élevés dans les plages 0 ≦ t ≦ 1 et 0 ≦ u ≦ 1.
[0032] Quel que soit le mode de mise en oeuvre, le procédé de préparation peut être complété par une étape supplémentaire de calcination de la phase solide à une température inférieure à 450° C, d'autant plus élevée que l'on désire un coefficient t plus faible dans la plage 0 ≦ t ≦ 1.
[0033] Cette calcination modifie la composition du biomatériau en transformant l'espèce péroxyde O₂²⁻ en oxygène moléculaire O₂. La calcination réduit donc le coefficient t au profit du coefficient u, mais on observe toutefois une perte globale d'oxygène, la somme t + u obtenue étant inférieure à la somme t + u initiale. De plus, cette calcination améliore l'état de cristallisation et réduit la solubilité du produit. Comme elle est effectuée à des températures moyennes, la solubilité finale du biomatériau calciné demeure toutefois suffisante pour lui conférer de bonnes propriétés antiseptiques dans le site d'implantation.
[0034] Pour l'obtention d'un biomatériau constitué par une association d'apatite oxygénée et d'un ou de matériaux supplémentaires du groupe évoqué précédemment, il suffit de mélanger par voie physique et de façon homogène la phase solide sèche de ApO obtenue avec le ou les composés désirés se présentant sous forme divisée ou sous forme de gel aqueux : HAp, PTCa, CaCO₃, CaSO₄, collagène, glycoaminoglycane, sulfate de chondroitine.
[0035] Dans le cas d'un gel aqueux de collagène, le mélange peut ensuite être lyophilisé afin d'obtenir une poudre sèche prête à l'emploi.
[0036] Pour préparer le biomatériau déjà défini dans laquel des ions hydrogénophosphates sont substitués par des ions carbonates, on ajoute dans la solution contenant l'eau oxygénée du carbonate de potassium ou de sodium et le procédé est ensuite mis en oeuvre comme déjà défini. En pratique, cet ajout demeure très faible par rapport à la quantité des autres composants (rapport atomique
< 0,05) afin d'obtenir une substitution très minoritaire.
[0037] La description qui suit fournit des exemples de préparation de biomatériaux conformes à l'invention et des résultats d'essais.
[0038] Les méthodes d'analyses utilisées sont dans tous les cas des méthodes classiques de la chimie du solide :
- diffraction des rayons X : la diffraction des rayons X permet de mettre en évidence la structure cristallographique en effectuant le dénombrement, la classification et la détermination des positions des raies. Un examen plus poussé permet en outre de définir les paramètres cristallins de la maille, et de donner une idée (largeur de raies) de l'état de cristallisation. Enfin, la diffraction des rayons X permet de s'assurer, à la sensibilité de la méthode, de la pureté du composé,
- spectrométrie d'absorption infrarouge : la spectrométrie d'absorption infrarouge permet de mettre en évidence les liaisons dans des groupements atomiques. Dans le cas des apatites on peut en particulier mettre en évidence :
. les ions hydroxydes : bandes à 3560 et 740 cm⁻¹,
. les ions carbonates domaine 1420 cm⁻¹,
. les bandes phosphate et plus particulièrement la bande due aux ions HPO₄=,
- détermination du phosphore : la détermination du phosphore (ions orthophosphate) est effectuée par analyse chimique par une méthode colorimétrique : formation du complexe phosphomolybdique jaune. Par cette méthode on détermine l'ensemble des ions orthophosphate (dans notre cas PO₄³⁻ et HPO₄=),
- détermination des ions HPO₄= : la détermination des seuls ions HPO₄= est effectuée par analyse avant et après calcination à 1000° C. Le dosage avant calcination permet de doser l'ensemble des ions PO₄³⁻ et HPO₄=. La calcination transforme les ions HPO₄= en ions P₂O₇⁴⁻. Le dosage après calcination et sans hydrolyse ne dose pas les ions P₂O₇⁴⁻. La différence entre le dosage avant et après calcination permet d'obtenir la valeur correspondant aux seuls ions HPO₄=,
- détermination de l'oxygène moléculaire : la détermination de l'oxygène moléculaire s'effectue par mesure du volume dégagé lors de la dissolution acide ; en présence de carbonate on doit préalablement absorber le CO₂ dégagé sur de l'amiante sodée,
- détermination des ions O₂= : après dissolution acide (acide perchlorique 1 N) on dose les ions O₂= par manganimétrie.
EXEMPLE 1 : PREPARATION DE BIOMATERIAU
[0039] On prépare une solution de 1 litre d'eau oxygénée à 30 volumes par dilution d'une solution commerciale à 110 volumes et on dissout dans cette solution 2,6 grammes de phosphate diammonique (NH₄)₂HPO₄ (solution 1). On prépare une solution de 100 millilitres d'eau contenant 7,08 grammes de nitrate de calcium (Ca(NO₃)₂,6H₂O) (solution 2). On porte la solution 1 à la température de 90° C et on amène le pH à la valeur de 8,5 par ajout de la quantité nécessaire d'ammoniaque. On verse la solution 2 dans la solution 1 en une seule fois ; on laisse une heure à la température de 90° C en maintenant le pH à la valeur de consigne 8,5. On sépare le précipité de sa solution mère par filtration sur buchner et on sèche le solide recueilli.
[0040] Tous les réactifs sont de qualité pharmaceutique. Cette préparation permet de préparer environ 3,5 grammes de biomatériau.
EXEMPLE DE PREPARATION N°2 :
[0042] On prépare une solution de 1 litre d'eau oxygénée à 30 volumes par dilution d'une solution commerciale à 110 volumes et on en fixe le pH à la valeur 8,5 par ajout d'une quantité suffisante d'ammoniaque diluée (au dixième). 50 grammes de phosphate tricalcique β( Ca₃(PO₄)₂) finement broyés sont ajoutés à cette solution. Cette suspension est agitée lentement au moyen d'un agitateur magnétique et chauffée à reflux pendant 10 heures à une température proche de l'ébullition. Une électrode de mesure du pH, supportant la température (type Métrohm), permet de contrôler le pH en permanence : en cas de variation il est ramené à la valeur de consigne 8,5 par ajout d'ammoniaque diluée au dixième. On laisse ensuite refroidir ; on sépare le solide de la solution par filtration sur buchner et on lave avec 2 litres d'eau distillée jusqu'à éliminer tous les sels en solution. On sèche le solide dans une étuve à 30° C pendant 5 heures, puis on le chauffe à l'air pendant 1 heure à 430° C. On obtient ainsi environ 45 grammes d'un solide pulvérulent ; il est caractérisé par diffraction des rayons X, spectrométrie d'absorption infrarouge et analyse chimique. Il répond à la formule :
Ca9,9(PO₄)5,9(HPO₄)0,1(OH)(O₂)0,5
EXEMPLE 3 : PREPARATION D'UNE PATE DE COMPLEMENT CANALAIRE
[0043] Une première préparation très simple a été réalisée ; elle consiste à mélanger soigneusement : 0,5 gramme d'apatite oxygénée préparée selon l'exemple n° 1, avec 0,5 gramme d'hydroxyapatite stoichiométrique et 0,1 gramme de sulfate de calcium anhydre (CaSO₄). Chacun des différents constituants est préalablement broyé (environ 5 microns) ; le mélange est également soigneusement homogénéisé. Il peut être conservé en flacon hermétiquement bouché. Au moment de l'emploi le mélange est rendu pâteux et amené à la consistance voulue par adjonction d'eau distillée (environ 1 ml pour 50 mg). Cette pâte peut être alors utilisée pour l'obturation canalaire au moyen des instruments professionnels couramment employés dans ce cas.
EXEMPLE 4 DE PREPARATION D'UNE PATE
[0044] La préparation est analogue à celle précédemment décrite ; on remplace simplement l'ajout d'eau distillée par l'ajout d'une solution à 0,5 % de collagène natif de veau.
EXEMPLE 5 DE PREPARATION DE GRANULES
[0045] Selon la méthode de préparation de l'exemple n° 2 on peut également préparer des granulés. Pour cela après lavage et filtration le solide est récupéré, séché à l'étuve à 80° C jusqu'à ce qu'il soit amené à une consistance convenant à la granulation (pourcentage en eau voisin de 10 %). Il est ensuite granulé dans une machine de type "FREWITT MG 6A". Le tamis supérieur est fixé à 400 microns et la coupure inférieure à 200 microns. Les granulés sont ensuite calcinés à l'air 1 heure à 430° C.
EXEMPLE 6 : RESULTATS D'ESSAIS IN VITRO
[0046] L'efficacité des biomatériaux conformes à l'invention à base d'apatites oxygénées a été testée in vitro sur des bactéries anaérobies. Deux souches ont été retenues :
- bacteroides fragilis (collection Institut Pasteur NCTC 9343),
- fusobacterium nucleatum (collection Institut Pasteur Ref 6039).
[0047] Ces deux souches ont été choisies parce qu'elles sont strictement anaérobies et qu'on les retrouve dans différentes pathologies humaines.
[0048] Le principe de ces tests in vitro consiste à mettre en présence les bactéries anaérobies avec différentes concentrations d'apatites en suspension (bouillon) dans des conditions contrôlées d'anaérobiose et à déterminer le nombre de ces bactéries après 48 heures et 72 heures de contact. Le témoin est constitué par une apatite ne contenant pas d'espèces oxygénées.
[0049] On observe dans les deux cas une réduction importante par un facteur 1000 du nombre de bactéries anaérobies.
EXEMPLE 7: IMPLANTATION IN VIVO
1/ - Biomatériau de comblement osseux ou dentaire, ayant des propriétés antiseptiques
en vue de limiter la prolifération des micro-organismes dans le site d'implantation,
caractérisé en ce qu'il comprend du phosphate de calcium oxygéné (ApO) ayant une structure
apatitique possédant des espèces oxygénées à des degrés d'oxydation supérieurs ou
égaux à -2, de formule :
Ca10-x □x (HPO₄)y (PO₄)6-y (OH)z (O₂²⁻)t □2-z-t(O₂)u
où □ représente une lacune,
0 ≦ x ≦ 1
0 ≦ y ≦ 1
0 ≦ t ≦ 1
0 ≦ u ≦ 1
u + t ≧ 0,2
et z = 2 + y - x - 2t
Ca10-x □x (HPO₄)y (PO₄)6-y (OH)z (O₂²⁻)t □2-z-t(O₂)u
où □ représente une lacune,
0 ≦ x ≦ 1
0 ≦ y ≦ 1
0 ≦ t ≦ 1
0 ≦ u ≦ 1
u + t ≧ 0,2
et z = 2 + y - x - 2t
2/ - Biomatériau selon la revendication 1, caractérisé en ce qu'il comprend un phosphate
de calcium oxygéné (ApO) de structure apatitique dans laquelle les coefficients sont
tels que :
0,1 ≦ x ≦ 0,4
y peu différent de x
t ≦
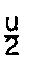
0,2 ≦ u ≦ 0,8
0,1 ≦ x ≦ 0,4
y peu différent de x
t ≦
0,2 ≦ u ≦ 0,8
3/ - Biomatériau selon la revendication 1, caractérisé en ce qu'il comprend un phosphate
de calcium oxygéné (ApO) de structure apatitique dans laquelle les coefficients sont
tels que :
0,2 ≦ x ≦ 0,5
y peu différent de x
0,8 ≦ t ≦ 1
u < 0,1
0,2 ≦ x ≦ 0,5
y peu différent de x
0,8 ≦ t ≦ 1
u < 0,1
4/ - Biomatériau selon la revendication 1, caractérisé en ce qu'il comprend un phosphate
de calcium oxygéné (ApO) de structure apatitique suivante :
Ca10-x □x (H PO₄)y (PO₄)6-y (OH)2+y-x □1-y (O₂)u
où 0 ≦ x ≦ 0,2
0 ≦ y ≦ 0,2
0,2 ≦ u ≦ 0,8
Ca10-x □x (H PO₄)y (PO₄)6-y (OH)2+y-x □1-y (O₂)u
où 0 ≦ x ≦ 0,2
0 ≦ y ≦ 0,2
0,2 ≦ u ≦ 0,8
5/ - Biomatériau selon l'une des revendications 1, 2, 3 ou 4, caractérisé en ce qu'il
comprend un mélange du phosphate de calcium apatitique oxygéné (ApO) de formule précitée
et d'un phosphate de calcium apatitique non oxygéné (HAp) de formule : Ca₁₀ (PO₄)₆
(OH)₂
6/ - Biomatériau selon l'une des revendications 1, 2, 3 ou 4, caractérisé en ce qu'il
comprend un mélange du phosphate de calcium apatitique oxygéné (ApO) de formule précitée
et d'un phosphate tricalcique (PTCa) de formule : Ca₃ (PO₄)₂.
7/ - Biomatériau selon l'une des revendications 1, 2, 3 ou 4, caractérisé en ce qu'il
comprend un mélange du phosphate de calcium apatitique oxygéné (ApO) de formule précitée
et de carbonate de calcium Ca CO₃ et/ou sulfate de calcium CaSO₄.
8/ - Biomatériau selon l'une des revendications 1, 2, 3 ou 4, caractérisé en ce qu'il
comprend un mélange de phosphate de calcium apatitique oxygéné (ApO) de formule précitée
et d'un collagène.
9/ - Biomatériau selon la revendication 8, caractérisé en ce qu'il comprend un mélange
du phosphate de calcium apatitique oxygéné (ApO), de collagène, de glycoaminoglycanes
et de sulfate de chondroitine.
10/ - Biomatériau selon l'une des revendications 1, 2, 3 ou 4, caractérisé en ce qu'il
comprend un mélange de phosphate de calcium apatitique oxygéné (ApO) de formule précitée
et de dérivés sanguins de coagulation, en particulier fibrine, fibrinogène.
11/ - Biomatériau selon l'une des revendications précédentes, caractérisé en ce qu'il
comprend du phosphate de calcium oxygéné (ApO) de structure apatitique dans laquelle
une fraction des ions hydrogénophosphates (HPO₄) est substituée par des ions carbonates
(CO₃).
12/ - Procédé de préparation d'un biomatériau conforme à l'une des revendications
1, 2, 3 ou 4, caractérisé en ce qu'il consiste à mettre en suspension un phosphate
calcique du groupe suivant : phosphate tricalcique (PTCa), phosphate dicalcique (DCPD)
ou phosphate octocalcique (OCP), dans une solution aqueuse contenant de l'eau oxygénée,
à laisser évoluer la suspension à un pH, à une température et pendant une durée fonctions
des coefficients x, y, t et u désirés, à séparer physiquement la phase solide et la
phase liquide et à sécher ladite phase solide.
13/ - Procédé de préparation d'un biomatériau conforme à l'une des revendications
1, 2, 3 ou 4, caractérisé en ce qu'il consiste à verser dans une solution aqueuse
contenant de l'eau oxygénée, d'une part un sel soluble de calcium, d'autre part du
phosphate d'ammonium, à un pH, à une température et pendant une durée fonctions des
coefficients x, y, t et u désirés, à laisser maturer le précipité obtenu dans la solution-mère,
à séparer physiquement la phase solide et la phase liquide et à sécher ladite phase
solide.
14/ - Procédé de préparation selon la revendication 13, caractérisé en ce que les
quantités de sel de calcium et de phosphate d'ammonium versées dans la solution aqueuse
d'eau oxygénée sont telles que le rapport atomique

soit compris entre 1,4 et 2.
soit compris entre 1,4 et 2.
15/ - Procédé de préparation selon l'une des revendications 12, 13 ou 14, caractérisé
en ce que le pH lors de l'évolution ou de la précipitation est fixé à une valeur comprise
entre 5 et 9, d'autant plus élevée que l'on désire des coefficients x et y plus faibles
dans les plages 0 < x ≦ 1 et 0 < y ≦ 1.
16/ - Procédé de préparation selon l'une des revendications 12, 13, 14 ou 15, caractérisé
en ce que la température lors de l'évolution ou de la précipitation est fixée à une
valeur comprise entre 20° C et 100° C, d'autant plus élevée que l'on désire des coefficients
x, y et t plus faibles dans les plages 0 < x ≦ 1, 0 < y ≦ 1 et 0 ≦ t ≦ 1.
17/ - Procédé de préparation selon l'une des revendications 12, 13, 14, 15 ou 16,
caractérisé en ce que la durée pendant laquelle on laisse évoluer la suspension ou
pendant laquelle s'effectue la précipitation est fixée à une valeur comprise entre
2 minutes et 300 heures, d'autant plus longue que l'on désire des coefficients x,
y et t plus faibles dans les plages 0 ≦ x ≦ 1 et 0 ≦ y ≦ 1 et 0 ≦ t ≦ 1.
18/ - Procédé de préparation selon l'une des revendications 12 à 17, caractérisé en
ce que la solution aqueuse contenant de l'eau oxygénée est choisie de concentration
comprise entre 5 et 50 volumes, d'autant plus élevée que l'on désire des coefficients
t et u plus élevés dans les plages 0 ≦ t ≦ 1 et 0 ≦ u ≦ 1.
19/ - Procédé de préparation selon l'une des revendications 12 à 18, caractérisé en
ce qu'il comprend une étape supplémentaire de calcination de la phase solide séparée,
à une température inférieure à 450°, d'autant plus élevée que l'on désire un coefficient
t plus faible dans la plage 0 ≦ t ≦ 1.
20/ - Procédé selon la revendication 12 pour préparer un biomatériau conforme à la
revendication 2, caractérisé en ce qu'il consiste :
. à préparer une solution aqueuse d'eau oxygénée de concentration comprise entre 25 et 35 volumes,
. à mettre en suspension le PTCa dans ladite solution aqueuse à une concentration comprise entre 10 et 50 g par litre,
. à laisser évoluer à reflux la suspension à un pH compris entre 8 et 9, et à une température et pendant une durée correspondant à la plage hachurée A du diagramme de la figure 1,
. à séparer la phase solide et à la sécher à une température inférieure à 100° C.
. à préparer une solution aqueuse d'eau oxygénée de concentration comprise entre 25 et 35 volumes,
. à mettre en suspension le PTCa dans ladite solution aqueuse à une concentration comprise entre 10 et 50 g par litre,
. à laisser évoluer à reflux la suspension à un pH compris entre 8 et 9, et à une température et pendant une durée correspondant à la plage hachurée A du diagramme de la figure 1,
. à séparer la phase solide et à la sécher à une température inférieure à 100° C.
21/ - Procédé selon la revendication 20 pour préparer un biomatériau conforme à la
revendication 2 ayant une teneur réduite d'ions péroxyde 0²⁻, caractérisé en ce que,
une fois séchée, la phase solide est calcinée à une température comprise entre 150°
et 300°, d'autant plus élevée que l'on désire un coefficient t plus faible.
22/ - Procédé selon la revendication 13 pour préparer un biomatériau conforme à la
revendication 3, caractérisé en ce qu'il consiste :
. à préparer une solution aqueuse d'eau oxygénée de concentration comprise entre 25 et 35 volumes,
. à verser dans ladite solution aqueuse d'eau oxygénée, d'une part, une solution aqueuse de nitrate ou d'acétate de calcium, d'autre part, une solution aqueuse de phosphate d'ammonium, de façon que le rapport atomique
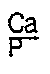
soit compris entre 1,5 et 1,7 ,
. à mélanger les solutions à un pH compris entre 8 et 9, à une température comprise entre 75° C et 100° C et pendant une durée comprise entre 2 et 10 minutes,
. à séparer, au terme de la durée précitée, la phase solide et à la sécher à une température inférieure à 100 ° C.
. à préparer une solution aqueuse d'eau oxygénée de concentration comprise entre 25 et 35 volumes,
. à verser dans ladite solution aqueuse d'eau oxygénée, d'une part, une solution aqueuse de nitrate ou d'acétate de calcium, d'autre part, une solution aqueuse de phosphate d'ammonium, de façon que le rapport atomique
soit compris entre 1,5 et 1,7 ,
. à mélanger les solutions à un pH compris entre 8 et 9, à une température comprise entre 75° C et 100° C et pendant une durée comprise entre 2 et 10 minutes,
. à séparer, au terme de la durée précitée, la phase solide et à la sécher à une température inférieure à 100 ° C.
23/ - Procédé selon la revendication 12 pour préparer un biomatériau conforme à la
revendication 4, caractérisé en ce qu'il consiste :
. à préparer une solution aqueuse d'eau oxygénée de concentration comprise entre 25 et 35 volumes,
. à mettre en suspension le PTCa dans ladite solution aqueuse à une concentration comprise entre 10 g et 50 g par litre,
. à laisser évoluer à reflux la suspension à un pH compris entre 8 et 9, et à une température et pendant une durée correspondant à la plage hachurée A du diagramme de la figure 1,
. à séparer la phase solide, à la sécher et à la calciner à une température comprise entre 400° C et 450° C.
. à préparer une solution aqueuse d'eau oxygénée de concentration comprise entre 25 et 35 volumes,
. à mettre en suspension le PTCa dans ladite solution aqueuse à une concentration comprise entre 10 g et 50 g par litre,
. à laisser évoluer à reflux la suspension à un pH compris entre 8 et 9, et à une température et pendant une durée correspondant à la plage hachurée A du diagramme de la figure 1,
. à séparer la phase solide, à la sécher et à la calciner à une température comprise entre 400° C et 450° C.
24/ - Procédé de préparation selon l'une des revendications 12 à 23 en vue d'obtenir
un biomatériau conforme à l'une des revendications 5 à 9, caractérisé en ce que la
phase solide sèche est mélangée avec au moins un composé du groupe suivant, se présentant
sous forme divisée ou sous forme de gel aqueux : HAp, PTCa, CaCO₃, CaSO₄, collagène,
glycoaminoglycane, sulfate de chondroitine.
25/ - Procédé de préparation selon l'une des revendications 12 à 24, en vue d'obtenir
un biomatériau conforme à la revendication 10, caractérisé en ce que l'on ajoute dans
la solution contenant l'eau oxygénée du carbonate de potassium, ou de sodium.
