|
(11) | EP 1 078 028 B1 |
| (12) | EUROPÄISCHE PATENTSCHRIFT |
|
|
| (54) |
VERWENDUNG VON MONOCYCLISCHEN ALDEHYDEN ALS RIECHSTOFFE UTILIZATION OF MONOCYCLIC ALDEHYDES AS ODORIFEROUS AGENTS UTILISATION D'ALDEHYDES MONOCYCLIQUES COMME MATIERES ODORANTES |
|
|
|||||||||||||||||||||||||||||||
| Anmerkung: Innerhalb von neun Monaten nach der Bekanntmachung des Hinweises auf die Erteilung des europäischen Patents kann jedermann beim Europäischen Patentamt gegen das erteilte europäischen Patent Einspruch einlegen. Der Einspruch ist schriftlich einzureichen und zu begründen. Er gilt erst als eingelegt, wenn die Einspruchsgebühr entrichtet worden ist. (Art. 99(1) Europäisches Patentübereinkommen). |
[0001] Die Erfindung betrifft die Verwendung spezieller monocyclischer Aldehyde, die erhältlich sind durch partielle oder vollständige Hydroformylierung von (Di)methyl-substituierten Cyclooct(adi)enen als Riechstoffe. Unter "Cyclooct(adi)enen" sind dabei sowohl Cyclooctadiene als auch Cyclooctene zu verstehen, also C8-Monocyclen mit einer oder zwei C=C-Doppelbindungen. Unter "(Di)methyl-substituiert" ist zu verstehen, daß das bicyclische System entweder ein oder zwei Methylgruppen als Substituenten trägt.
Stand der Technik
[0002] Die Hydroformylierung cyclischer Diene ist literaturbekannt. So beschreibt beispielsweise A. Spencer in Journal of Organometallic Chemistry 1977, 124, Seiten 85 - 91 die Hydroformylierung von unter anderem 1,3- und 1,5-Cyclooctadien in Gegenwart spezieller Rhodiumkatalysatoren. Aus JP 58/21638 ist ein Herstellungsverfahren für Dialdehyde bekannt, bei dem nicht-konjugierte Diolefine in einem nicht mit Wasser mischbaren Lösungsmittel in Gegenwart eines Rhodium-Katalysators mit Wasserstoff und Kohlenmonoxyd umgesetzt werden. Aus US 3 985 769 ist Cyclooctanaldehyd (1), der gemäß als Rohstoff für die
[0003] Herstellung davon abgeleiteter Acetale mit Dufteigenschaften beschrieben wird, hinsichtlich seiner geruchlichen Eigenschaften, die als "intensiv grün" beschrieben werden, bekannt.
[0004] Viele natürliche Riechstoffe stehen gemessen am Bedarf in völlig unzureichender Menge zur Verfügung. Es ist daher klar, daß die Riechstoffindustrie einen ständigen Bedarf an neuen Riechstoffen mit interessanten Duftnoten hat, um die Palette der natürlich verfügbaren Riechstoffe zu ergänzen und die notwendigen Anpassungen an wechselnde modische Geschmacksrichtungen vornehmen sowie den ständig steigenden Bedarf ans geruchsverbessernden für Produkte des täglichen Bedarfs wie Kosmetika und Reinigungsmittel decken zu können.
[0005] Darüberhinaus besteht generell ein ständiger Bedarf an synthetischen Riechstoffen, die sich günstig und mit gleichbleibender Qualität herstellen lassen und erwünschte olfaktorische Eigenschafen haben, das heißt angenehme, möglichst natumahe und qualitativ neuartige Geruchsprofile von ausreichender Intensität besitzen und in der Lage sind, den Duft von kosmetischen und Verbrauchsgütern vorteilhaft zu beeinflussen. Es besteht daher Bedarf an Verbindungen, die charakteristische neue Geruchsprofile bei gleichzeitig hoher Haftfestigkeit, Geruchsintensität und Strahlkraft haben.
Beschreibung der Erfindung
[0006] Überraschenderweise wurde gefunden, daß Aldehyde, die erhältlich sind durch partielle oder vollständige Hydroformylierung von (Di)methyl-substituierten Cyclooct(adi)enen über bemerkenswerte Geruchseigenschaften verfügen. Über ihre spezielle Geruchscharakteristik hinaus, die durch eine große Bandbreite mit komplexen Schattierungen gekennzeichnet ist, zeichnen sich die Verbindungen durch gute Haftfestigkeit und Strahlkraft aus. Darüber hinaus eignen sie sich in ausgezeichneter Weise als Duft-Booster. Unter einem Duft-Booster ist dabei eine Substanz zu verstehen, die in der Lage ist, die geruchlichen Eindrücke der Komponenten eines Mehrstoff-Systems, d.h. einer Mischung zweier oder mehrerer Riechstoffe, nachhaltig zu intensivieren.
[0007] Gegenstand der Erfindung ist die Verwendung von monocyclischen Aldehyden, die erhältlich sind durch partielle oder vollständige Hydroformylierung von (Di)methyl-substituierten Cyclooct(adi)enen, als Riechstoffe.
[0008] Ein weiterer Gegenstand der Erfindung ist die Verwendung von monocyclischen Aldehyden, die erhältlich sind durch partielle oder vollständige Hydroformylierung von (Di)methyl-substituierten Cyclooct(adi)enen, als Duft-Booster. Hinsichtlich dieser Verwendung sind die unten näher beschriebenen Verbindungen (3a), (3b) und (3c) besonders bevorzugt.
[0009] Die Herstellung der erfindungsgemäß einzusetzenden Aldehyde geschieht vorteilhaft durch Hydroformylierung von (Di)methyl-substituierten Cyclooct(adi)enen. Die letztgenannten Verbindungen weisen als gemeinsames Grundgerüst ein Cyclooctan-System auf. Das Grundgerüst - jedoch ohne die Angabe von Methylgruppen und C=C-Doppelbindungen wird durch die folgende Formel (2) veranschaulicht:
[0010] Dieses System (2) enthält ein oder zwei Methylgruppen und ein oder zwei C=C-Doppelbindungen. Sofern zwei C=C-Doppelbindungen vorliegen gilt, daß diese nicht unmittelbar benachbart sind.
[0011] Bei der Hydroformylierung handelt es sich um eine dem Fachmann bekannte Reaktion, die bereits 1938 durch von Roelen entdeckt wurde. Dabei werden Alkene mit Kohlenmonoxyd und Wasserstoff in Aldehyde überführt. Die Reaktion ist auch als Oxo-Synthese bekannt.
[0012] Sofern im Rahmen der vorliegenden Erfindung als Ausgangsstoffe (Di)methyl-substituierte Cyclooctadiene eingesetzt werden, kann die Hydroformylierung partiell oder vollständig durchgeführt werden. Bei der partiellen Hydroformylierung bleibt eine olefinische Doppelbindung pro Molekül der Ausgangsverbindung erhalten, während nur die andere hydroformylieil wird, bei der vollständigen Hydroformylierung werden zwei CHO-Gruppen in das Molekül eingeführt. Sofern jedoch als Ausgangsstoffe (Di)methyl-substituierte Cyclooctene eingesetzt werden, ist selbstverständlich lediglich die vollständige Hydroformylierung möglich, da nur eine olefinische Doppelbindung pro Molekül der Ausgangsverbindung vorhanden ist.
[0013] Das Geruchsprofil der erfindungsgemäßen Hydroformylierungsprodukte ist originell und neuartig. In Parfüm-Kompositionen verstärken sie die Harmonie und Ausstrahlung sowie auch die Haftung, wobei die Dosierung unter Berücksichtigung der übrigen Bestandteile der Komposition auf die jeweils angestrebte Duftnote abgestimmt wird.
[0014] Daß die erfindungsgemäßen Hydroformylierungsprodukte interessante parfümistische Noten aufweisen, war nicht vorhersehbar und ist eine Bestätigung für die allgemeine Erfahrung, daß die olfaktorischen Eigenschaften bekannter Riechstoffe keinen zwingenden Rückschluß auf die Eigenschaften im weitesten Sinne "strukturanaloger" Verbindungen - im vorliegenden Fall etwa Cyclooctanaldehyd (1) - oder deren Mischungen untereinander zulassen, weil weder der Mechanismus der Duftwahrnehmung noch der Einfluß der chemischen Struktur auf die Duftwahrnehmung hinreichend erforscht sind, somit also normalerweise nicht vorhergesehen werden kann, ob ein geänderter Aufbau oder spezielle Mischungsverhältnisse bekannter Riechstoffe überhaupt zur Änderung der olfaktorischen Eigenschaften führt und ob diese Änderung positiv oder negativ zu beurteilen ist.
[0015] Die erfindungsgemäßen Hydroformylierungsprodukte eigenen sich aufgrund ihrer Geruchsprofile insbesondere auch zur Modifizierung und Verstärkung bekannter Kompositionen. Hervorgehoben werden soll insbesondere ihre außerordentliche Geruchsstärke, die ganz allgemein zur Veredlung von Kompositionen beiträgt.
[0016] Bemerkenswert ist ferner die Art und Weise, wie die erfindungsgemäßen Hydroformylierungsprodukte die Geruchsnoten einer breiten Palette bekannter Kompositionen abrunden und harmonisieren, ohne jedoch in unangenehmer Weise zu dominieren.
[0017] In ganz besonderer Weise eignet sich die Verbindungen (3a), (3b) und (3c) - vergleiche hierzu die untenstehenden Strukturformeln - für die erfindungsgemäße Verwendung als Riechstoff und/oder Duft-Booster. Dementsprechend ist der Einsatz der Verbindungen (3a), (3b) und (3c) beispielsweise in Raumbeduftern besonders vorteilhaft. Darüber hinaus hat sich gezeigt, daß die Verbindungen (3a), (3b) und (3c) mit besonderen Vorteilen in Reinigungsmitteln zur Verstärkung von Zitrusditften eingesetzt werden können.
[0018] Die Verbindungen (3a), (3b) und (3c) lassen sich beispielsweise durch Hydroformylierung der entsprechenden (Di)methyl-substituierten Cycloocten- bzw. Cyclooctadien-Systeme herstellen.
[0019] (3b) fällt dabei in der Regel in Form eines (E,Z)-Gemisches an, d.h. die C=C-Doppelbindung kann sowohl E- als auch Z-konfiguriert sein, wobei in aller Regel ein Gemisch vorliegen wird, in dem die Z-Konfiguration überwiegt. Es kann jedoch auch gewünscht sein, die E- bzw. Z-konfigurierte Form in Reinsubstanz einzusetzen.
[0020] Die einsetzbaren Anteile der erfindungsgemäßen Hydroformylierungsprodukte in Riechstoffkompositionen bewegen sich von 0,001 bis 70 Gew.-%, bezogen auf die gesamte Mischung. Die erfindungsgemäßen Hydroformylierungsprodukte sowie Kompositionen dieser Art können sowohl zur Parfümierung kosmetischer Präparate wie Lotionen, Cremes, Shampoos, Seifen, Salben, Puder, Aerosole, Zahnpasten, Mundwässer, Deodorantien als auch in der Extraitparfümerie verwendet werden. Ebenso besteht eine Einsatzmöglichkeit zur Parfümierung technischer Produkte sowie Wasch- und Reinigungsmittel, Weichspüler, Textilbehandlungsmittel oder Tabak. Zur Parfümierung dieser verschiedener Produkte werden diesen die Kompositionen in einer olfaktorisch wirksamen Menge, insbesondere in einer Konzentration im Bereich von 0,05 bis 2 Gew.-%, bezogen auf das gesamte Produkt, zudosiert. Diese Werte sollen jedoch keine Grenzwerte darstellen, da der erfahrene Parfümeur auch mit geringeren Konzentrationen Effekte erzielen oder aber mit noch höheren Dosierungen neuartige Komplexe aufbauen kann.
[0021] Die vorliegenden Beispiele sollen den Gegenstand der Erfindung erläutern und sind nicht einschränkend aufzufassen.
Beispiele
1. Herstellung von 2,6-Dimethyl-1-Formyl-cyclooctan (3a)
[0023] 2 mol (272,46 g) 1,5-Dimethyl-1,5-cyclooctadien (Hersteller: Fa. Shell; gaschromatographisch bestimmte Reinheit: 75%) wurden mit 1,7 mmol (1,175 g) eines Rhodium-Katalysators der Formel Rh(CO)Cl(PPh3)2 und 19 mmol (5 g) Triphenylphosphin zusammen in einem Autoklaven vorgelegt und ohne Lösungsmittel unter starker Durchmischung mit einer 1 : 1 Mischung Wasserstoff/Kohlenmonoxid bei einem Druck von 60 kg/cm2 bei 100 °C für 5 Stunden zur Reaktion gebracht. Zur Aufarbeitung wurde der Reaktorinhalt filtriert und über eine 20 cm Vigreux-Kolonne destilliert.
[0024] Die anschließende Fraktionierung erfolgte an einer Drehbandkolonne. Es wurden 82 g Monoaldehyd (3a) erhalten (Siedepunkt: 65 °C/ 16 mbar), daneben 35,4 g Dialdehyd (Siedepunkt: 105 °C/ 16 mbar).
2. Herstellung von 2,6-Dimethyl-5-Formyl-cyclooct-1-en (3b)
[0027] 2 mol (272,46 g) 1,5-Dimethyl-1,5-cyclooctadien (Hersteller: Fa. Aldrich; gaschromatographisch bestimmte Reinheit: 76%) wurden mit 1,7 mmol (1,175 g) eines Rhodium-Katalysators der Formel Rh(CO)Cl(PPh3)2 und 19 mmol (5 g) Triphenylphosphin zusammen in einem Autoklaven vorgelegt und ohne Lösungsmittel unter starker Durchmischung mit einer 1 : 1 Mischung Wasserstoff/Kohlenmonoxid bei einem Druck von 60 kg/cm2 bei 100 °C für 5 Stunden zur Reaktion gebracht. Zur Aufarbeitung wurde der Reaktorinhalt filtriert und über eine 20 cm Vigreux-Kolonne destilliert.
[0028] Die Fraktionierung in Edukt und Monoaldehyd erfolgte an einer Drehbandkolonne. Es wurden 132 g Produkt (3b) erhalten (Siedepunkt: 58 °C/ 16 mbar).
3. Herstellung von 2,6-Dimethyl-1,5-Di-Formyl-cyclooctan (3c)
[0031] 2 mol (272,46 g) 1,5-Dimethyl-1,5-cyclooctadien (Hersteller: Fa. Shell; gaschromatographisch bestimmte Reinheit: 98%) wurden mit 1,7 mmol (1,175 g) eines Rhodium-Katalysators der Formel Rh(CO)Cl(PPh3)2 und 19 mmol (5 g) Triphenylphosphin zusammen in einem Autoklaven vorgelegt und ohne Lösungsmittel unter starker Durchmischung mit einer 1 : 1 Mischung Wasserstoff/Kohlenmonoxid bei einem Druck von 60 kg/cm2 bei 100 °C für 5 Stunden zur Reaktion gebracht. Zur Aufarbeitung wurde der Reaktorinhalt filtriert und über eine 20 cm Vigreux-Kolonne destilliert.
1. Verwendung von monocyclischen Aldehyden, die erhältlich sind durch partielle oder
vollständige Hydroformylierung von (Di)methyl-substituierten Cyclooct(adi)enen als
Riechstoffe.
2. Verwendung der monocyclischen Aldehyde der nachstehenden Strukturformeln
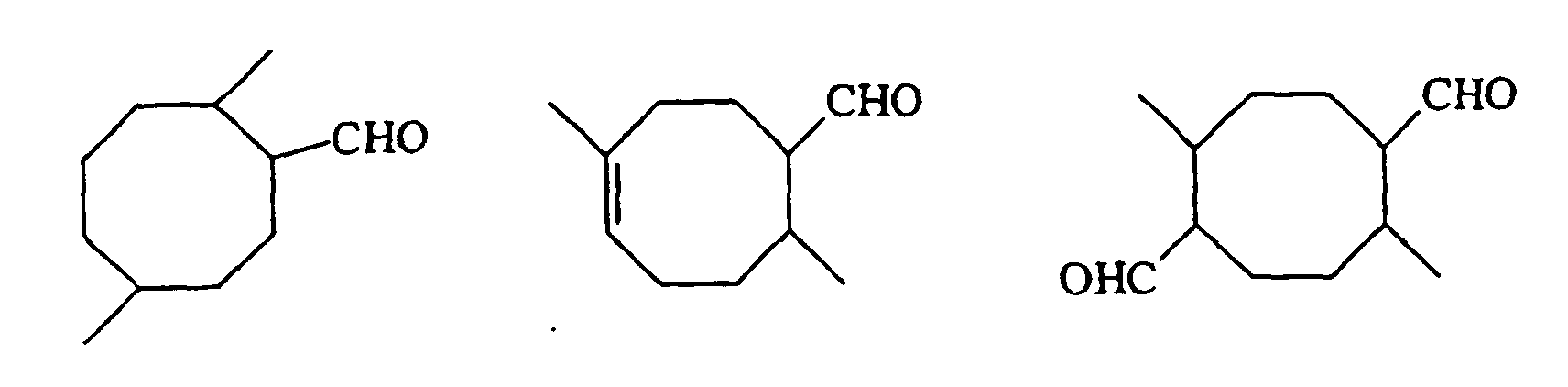
als Riechstoffe.
als Riechstoffe.
3. Verwendung von monocyclischen Aldehyden, die erhältlich sind durch partielle oder
vollständige Hydroformylierung von (Di)methyl-substituierten Cyclooct(adi)enen, als
Duft-Booster.
4. Venvendung der monocyclischen Aldehyde der nachstehenden Strukturformeln
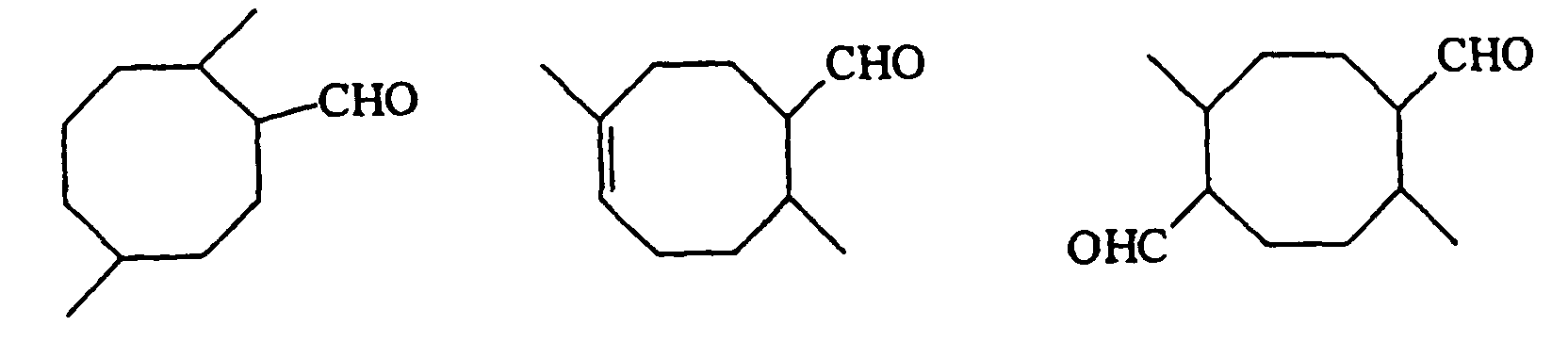
als Duft-Booster.
als Duft-Booster.
5. Verwendung von monocyclischen Aldehyden, die erhältlich sind durch partielle oder
vollständige Hydroformylierung von (Di)methyl-substituierten Cyclooct(adi)enen, in
kosmetischen Präparaten, technischen Produkten oder der alkoholischen Parfümerie.
6. Verwendung der monocyclischen Aldehyde der nachstehenden Strukturformeln
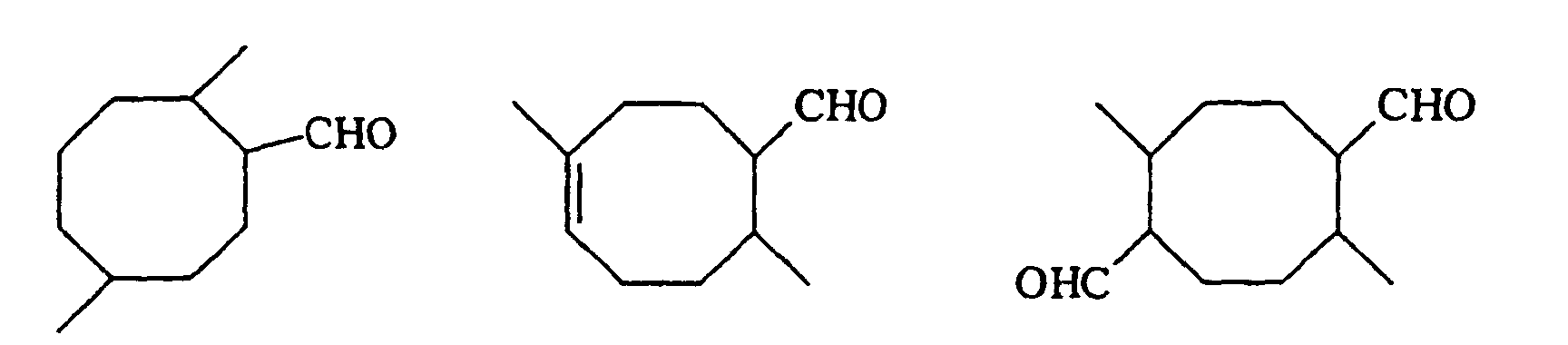
in kosmetischen Präparaten, technischen Produkten oder der alkoholischen Parfümerie.
in kosmetischen Präparaten, technischen Produkten oder der alkoholischen Parfümerie.
1. Use of monocyclic aldehydes which can be obtained by partial or complete hydroformylation
of (di)methyl-substituted cyclooct(adi)enes as odorous substances.
2. Use of the monocyclic aldehydes of the following structural formulae
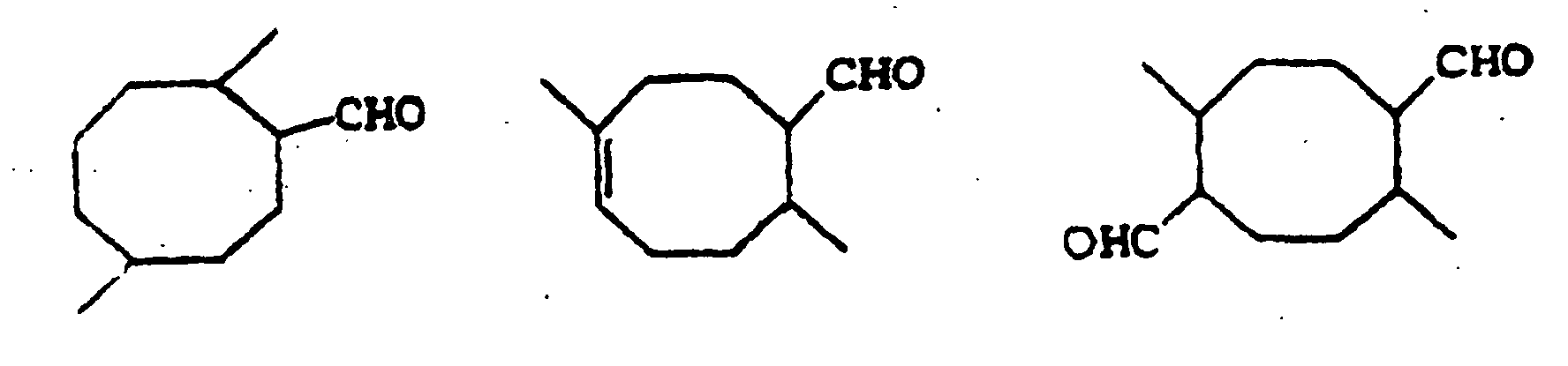
as odorous substances.
as odorous substances.
3. Use of monocyclic aldehydes which can be obtained by partial or complete hydroformylation
of (di)methyl-substituted cyclooct(adi)enes as fragrance boosters.
4. Use of the monocyclic aldehydes of the following structural formulae
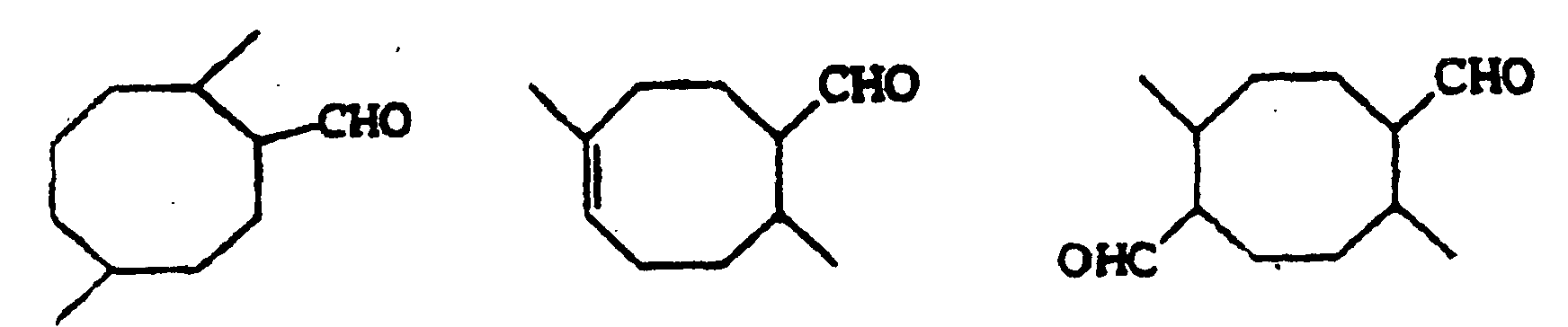
as fragrance boosters.
as fragrance boosters.
5. Use of monocyclic aldehydes which can be obtained by partial or complete hydroformylation
of(di)methyl-substituted cyclooet(adi)enes in cosmetic preparations, industrial products
or alcoholic perfumery.
6. Use of the monocyclic aldehydes of the following structural formulae
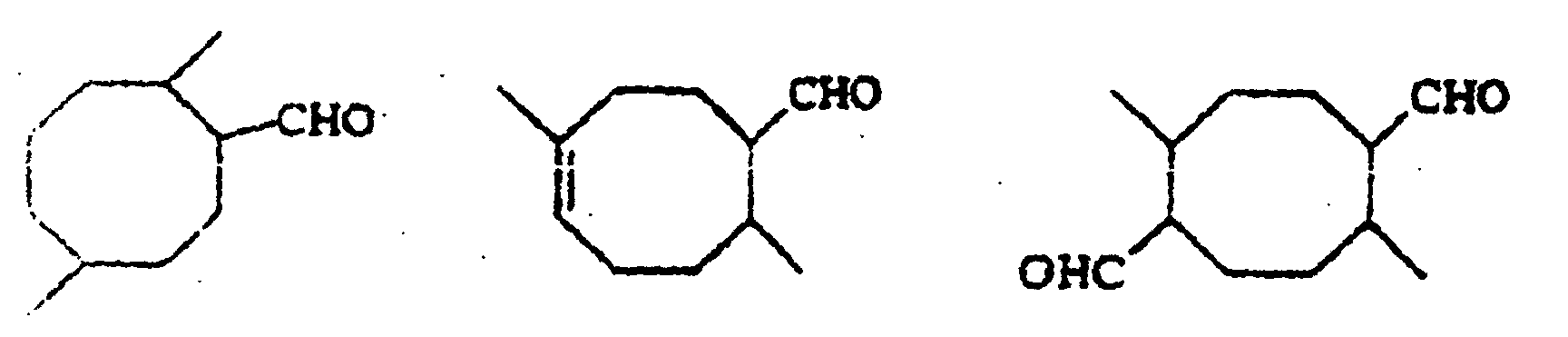
in cosmetic preparations, industrial products or alcoholic perfumery.
in cosmetic preparations, industrial products or alcoholic perfumery.
1. Utilisation d'aldéhydes monocycliques que l'on peut obtenir par hydroformylation partielle
ou complète de cyclooct(adi)ènes à substitution diméthyle comme produits odorants.
2. Utilisation des aldéhydes monocycliques de formule développée ci-dessous
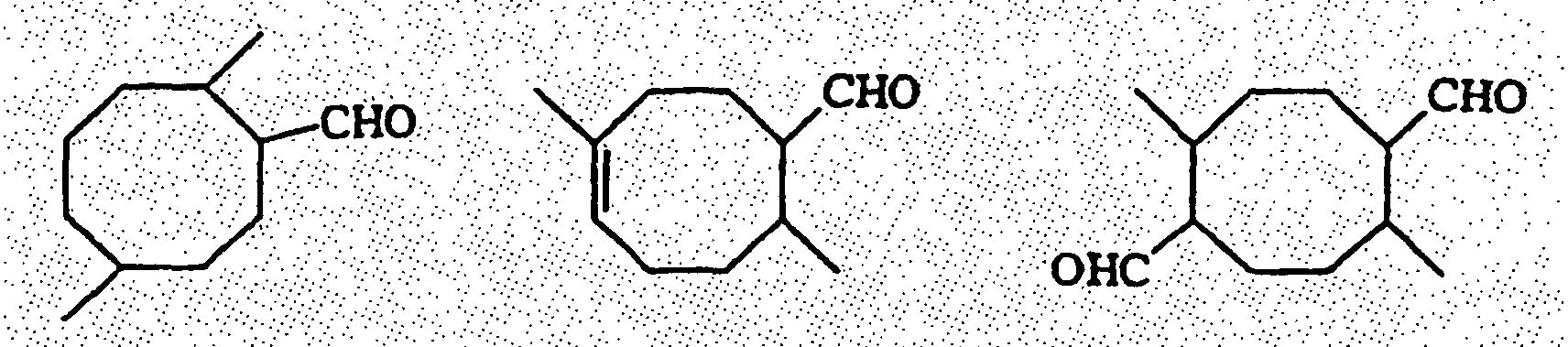
comme produits odorants.
comme produits odorants.
3. Utilisation d'aldéhydes monocycliques que l'on peut obtenir par hydroformylation partielle
ou complète de cyclooct(adi)ènes à substitution diméthyle comme renforçateurs de parfum.
4. Utilisation des aldéhydes monocycliques de formules développées ci-dessous

comme renforçateurs de parfum.
comme renforçateurs de parfum.
5. Utilisation d'aldéhydes monocycliques que l'on peut obtenir par hydroformylation partielle
ou complète de cyclooct(adi)ènes à substitution diméthyle, dans des préparations cosmétiques,
des produits industriels ou en parfumerie alcoolique.
6. Utilisation des aldéhydes monocycliques de formules développées ci-dessous

dans des préparations cosmétiques, des produits industriels ou en parfumerie alcoolique.
dans des préparations cosmétiques, des produits industriels ou en parfumerie alcoolique.
